Hafnium

- 4479
- 836
- Alan Milota
 Vzorka kovového hafnio. Zdroj: Hi-res obrázky chemických prvkov [CC BY (https: // creativeCommons.Org/licencie/o/3.0)]
Vzorka kovového hafnio. Zdroj: Hi-res obrázky chemických prvkov [CC BY (https: // creativeCommons.Org/licencie/o/3.0)] Čo je hafnio?
On hafnium Je to prechodný kov, ktorého chemikália je HF a má atómový počet 72. Je to tretí prvok skupiny 4 periodickej tabuľky, ktorá je v titáne a okolnostiach kongén. S druhým zdieľa mnoho chemických vlastností, ktoré sa nachádzajú spolu v mineráloch zemskej kôry.
Hľadáte hafnio, kde sa pozerá na miesto zirkónia, pretože je vedľajším produktom jeho extrakcie. Názov tohto kovu pochádza z latinského slova „hafnia“, ktorého význam je názov Kodaň, mesto, kde bolo objavené v zirkónových mineráloch a kontroverzia sa skončila vzhľadom na jeho skutočnú chemickú povahu.
Tento kov sa rozlišuje tým, že je posledným z najstabilnejších prvkov objavených tu na Zemi; To znamená, že ďalšie objavy predstavovali sériu ultraesadí, rádioaktívnych a/alebo umelých izotopov.
Hafnio zlúčeniny sú analogické s titánom a cirónom, prevažne oxidačné číslo +4, ako je HFCL4, HFO2, Hfi4 a HFBR4. Niektorí z nich vedú zoznam najžiadanejších materiálov, aké kedy boli vytvorené, ako aj zliatiny veľkého tepelného odporu a tiež pôsobia ako vynikajúce absorpcie neutrónov.
Z tohto dôvodu má Hafnio veľa účasti na jadrovej chémii, najmä na tlakových vodných reaktoroch.
Objavenie
Prechodný kov alebo vzácne zeminy
Objav Hafnio bol obklopený kontroverziami, hoci jeho existencia bola už predpovedaná od roku 1869 vďaka Mendeleev Periodic Table.
Problém bol v tom, že bol umiestnený pod zirkónom, ale zhodoval sa v rovnakom období prvkov vzácnych zemín: lantanoides. Chemici v tom čase nevedeli, či to bol prechodný kov alebo kov zo vzácnych zemín.
 99,9% hafnium bar. Zdroj- alchemista-HP (www.PSE-Mendelejew.z), CC By-SA 2.0, cez Wikimedia Commons
99,9% hafnium bar. Zdroj- alchemista-HP (www.PSE-Mendelejew.z), CC By-SA 2.0, cez Wikimedia Commons Francúzsky chemik Georges Ubain, objavca Luthacio, susedný kov Hafnio, uviedol, že v roku 1911 objavil prvok 72, ktorý Celtio nazval a vyhlásil, že ide o kov vzácnych zemín. Ale o tri roky neskôr sa dospelo k záveru, že jeho výsledky boli nesprávne a že izolovala iba zmes latanoidov.
Až v roku 1914 sa ich atómové čísla nariadili prvky, a to vďaka práci Henryho Moseleyho v roku 1914, ktorú susedstvo medzi Luthate a Element 72 bolo dôkazom tej istej skupiny ako titán a kovy v oblasti citlivých.
Môže vám slúžiť: flokulácia: reakcia, typy, aplikácie, príkladyDetekcia v Kodani
V roku 1921, po štúdiách atómovej štruktúry Niels Bohr a jej predikcii emisného spektra X -Ray pre prvok 72, bol tento kov zastavený v mineráloch vzácnych zemín; A namiesto toho sa zameriavalo na jeho hľadanie na mineránoch Circonium, pretože oba prvky museli zdieľať niekoľko chemických vlastností.
Dánsky chemik Dirk Coster a maďarský chemik Georg von Hevesy v roku 1923 konečne rozpoznal predpovedané spektrum Niels Bohr vo vzorkách zirkónu z Nórska a Grónska. Po objavení v Kodani nazvali prvok 72 podľa latinského názvu tohto mesta: Hafnia, ktoré neskôr odvodilo „Hafnio“.
Izolácia a výroba
Nebola to však ľahká úloha. Aj keď v roku 1924 bola navrhnutá metóda frakčnou rekryštalizáciou, aby sa získal hafnio tetrachlorid, HFCL4, Boli to holandské chemikálie Anton Eduard Van Arkel a Jan Hendrik de Boer, ktorí ho znížili na kovové hafnium.
Na to, HFCL4 Prešiel redukciou pomocou kovového horčíka (proces Kroll):
HFCL4 + 2 mg (1100 ° C) → 2 mgcl2 + HF
Na druhej strane, počnúc Hafnio Tetrayoduro, HFI4, Toto bolo odparované, aby sa utrpel tepelným rozkladom na žiarovkovom volfrámovom vlákne, na ktorom bolo uložené kovové hafnium, aby spôsobilo polykryštalický vzhľad vzhľadu (proces kryštalického stĺpca alebo proces ARKEL-BOER):
Hfi4 (1700 ° C) → HF + 2 I2
Hafnio štruktúra
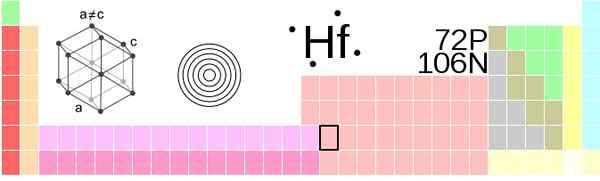 Hafnio umiestnenie v periodickej tabuľke. Fontána: !Originál: AhoteseierVector: Sushant Savla, CC BY-SA 3.0, cez Wikimedia Commons
Hafnio umiestnenie v periodickej tabuľke. Fontána: !Originál: AhoteseierVector: Sushant Savla, CC BY-SA 3.0, cez Wikimedia Commons Hafnio, atómy HF, sú zoskupené do okolitého tlaku na kompaktný šesťuholníkovú štruktúru, HCP, rovnako ako kovy titánu a zirkónia. Tento kryštál HAFNIO HCP sa stáva jeho fázou a, ktorá zostáva konštantná až do teploty 2030 K, keď trpí prechodom do β fázy, s kubickou štruktúrou sústredenou v tele, BCC, BCC.
Toto sa chápe, ak sa tepla „uvoľní“, zvažuje sa sklo, a preto sa atómy HF snažia postaviť tak, aby sa ich zhutňovanie znížilo. Tieto dve fázy stačia na zváženie polymorfizmu hafnium.
Predstavuje tiež polymorfizmus, ktorý závisí od vysokých tlakov. Fázy a a p existujú pri tlaku 1 atm; Kým Ω, šesťuholníková, ale ešte zhutnená fáza ako obyčajná HCP, sa objaví, keď tlaky presahujú 40 GPA. Je zaujímavé, že keď sa tlaky naďalej zvyšujú, objaví sa fáza β, najmenej hustá.
Môže vám slúžiť: kyselina seleenhydrová (H2SE): Čo je, štruktúra, vlastnosti, použitiaVlastnosti hafnio
Fyzický vzhľad
Strieborná biela pevná látka, ktorá vykazuje tmavé tóny, ak má vrstvu oxidu a nitridu.
Molárna hmota
178,49 g/mol
Bod topenia
2233 ° C
Bod varu
4603 ° C
Hustota
Pri izbovej teplote: 13,31 g/cm3, je dvakrát hustejšie ako okolnosti
Priamo v bode topenia: 12 g/cm3
Fúzne teplo
27,2 kJ/mol
Odparovanie
648 kj/mol
Elektronegativita
1.3 v Pauling Scale
Ionizačné energie
Prvé: 658,5 kJ/mol (hf+ plyn)
Po druhé: 1440 kJ/mol (hf2+ plyn)
Tretie: 2250 kJ/mol (HF3+ plyn)
Tepelná vodivosť
23,0 w/(m · k)
Elektrický odpor
331 NΩ · m
Mohs tvrdosť
5.5
Reaktivita
Pokiaľ nie je kov pula a horí, vypaľujú iskry pri teplote 2000 ° C, nemá náchylnosť na oxidáciu alebo spustenie, pretože tenká vrstva jeho oxidu ju chráni. V tomto zmysle je to jeden z najstabilnejších kovov. V skutočnosti ich môžu rozpustiť kyseliny alebo silné bázy; S výnimkou kyseliny fluórhy a halogény, ktoré sú schopné oxidovať.
Elektronická konfigurácia
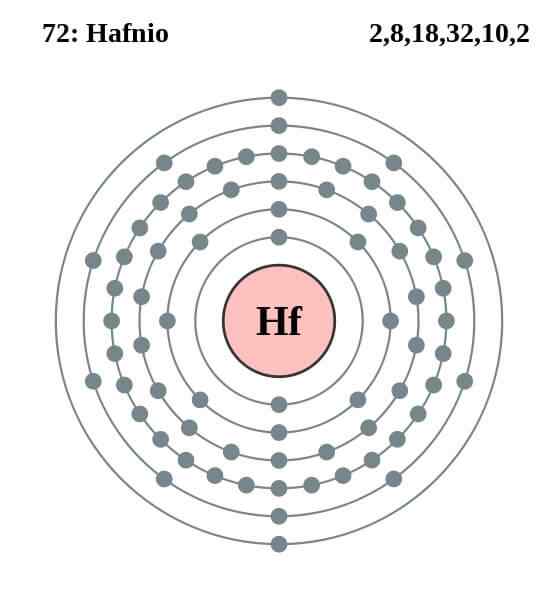 Elektronická konfigurácia Hafnio
Elektronická konfigurácia Hafnio Hafnio's Atom má nasledujúcu elektronickú konfiguráciu:
[Xe] 4f14 5 D2 6s2
To sa zhoduje so skutočnosťou, že patrí do skupiny 4 periodickej tabuľky spolu s titánom a cirónom, pretože má štyri elektróny vo Valencii na orbitáloch 5D a 6S. Všimnite si, že Hafnio nemohol byť latanoid, pretože má úplne plné orbitály 4F.
Oxidácia
Rovnaká elektronická konfigurácia odhaľuje, koľko elektrónov je schopných stratiť atóm Hafnio, keď je súčasťou zlúčeniny. Za predpokladu, že stratí svoje štyri elektróny vo Valencii, bol by tetravalentný katión HF4+ (Analogicky vám4+ a Zr4+), A preto by mal oxidačné číslo +4.
Toto je v skutočnosti najstabilnejšie a najbežnejšie z jeho oxidačných čísel. Ďalšie menej relevantné sú: -2 (HF2-), +1 (hf+), +2 (hf2+) a +3 (hf3+).
Izotopy
Hafnio je prezentovaný na Zemi ako päť stabilných izotopov a rádioaktívne s veľmi veľkým časom života:
-174HF (0,16%, s polovičným životom 2,10pätnásť roky, takže sa považuje za prakticky stabilný)
-176HF (5,26%)
-177HF (18,60%)
Môže vám slúžiť: Slabé základne-178HF (27,28%)
-179HF (13,62%)
-180HF (35,08%)
Všimnite si, že neexistuje taký izotop ako taký, ktorý vyniká v hojnosti, a to sa odráža v priemernej atómovej hmotnosti Hafnio, 178.49 Uma.
Zo všetkých rádioaktívnych izotopov hafnio, ktoré spolu s domorodcami spolu celkom 34, 178 m2HF je najkontroverznejšia, pretože vo svojom rádioaktívnom rozpade vydáva gama žiarenie, takže tieto atómy by sa mohli použiť ako vojnová zbraň.
Použitie/aplikácie
 Hafnio pokryté tenkou vrstvou oxidu. Zdroj: Alchymist-HP (Talk) (www.PSE-Mendelejew.De), fal, cez Wikimedia Commons
Hafnio pokryté tenkou vrstvou oxidu. Zdroj: Alchymist-HP (Talk) (www.PSE-Mendelejew.De), fal, cez Wikimedia Commons Jadrové reakcie
Hafnio je kov rezistentný na vlhkosť a vysoké teploty, okrem toho, že je vynikajúcim absorbentom neutrónov. Z tohto dôvodu sa používa v tlakových vodných reaktoroch, ako aj pri výrobe kontrolných tyčiniek pre jadrové reaktory, v ktorých povlaky sú vyrobené z ultrapuro obvodu.
Zliatiny
Atómy Hafnio môžu integrovať ďalšie kovové kryštály, aby vznikli rôzne zliatiny. Vyznačujú sa tým, že sú húževnaté a tepelne odolné, takže sú určené na priestorové aplikácie, ako pri konštrukcii motorových dýz pre rakety.
Na druhej strane, niektoré zliatiny a pevné zlúčeniny Hafnio majú špeciálne vlastnosti; ako sú ich karbidy a dusičnany, HFC a HFN, ktoré sú veľmi žiaruvzdornými materiálmi. Tantalo a Hafnio Carbide, TA4HFC5, Pri fúznom bode 4215 ° C je jedným z najžiadanejších materiálov, aké kedy boli známe.
Katalýza
Hafnioove metalocenes sa používajú ako organické katalyzátory pre syntézu polymelénu, ako je polyetylén a polystyrén.
Riziká
Nie je známe, aký dopad môže mať HF ióny v našom tele4+. Na druhej strane, pretože sa nachádzajú v prírode v zirkóniových mineráloch, neverí sa, že sa zmenia ekosystém oslobodenia svojich solí do životného prostredia.
Teraz sa odporúča starostlivo manipulovať s hafnio zlúčeninami, akoby boli toxické, aj keď neexistujú žiadne lekárske štúdie, ktoré by dokazovali, že sú škodlivé pre zdravie.
Skutočné nebezpečenstvo hafnio leží v časticiach jeho jemne mletej pevnej látky, ktorá môže horieť práve vtedy, keď prídu do styku s kyslíkom vzduchu.
To vysvetľuje, prečo, keď je leštené, pôsobenie, ktoré zoškraba jeho povrch a vydáva čisté kovové častice, sa spaľujúce iskry uvoľňujú s teplotou 2000 ° C; To znamená, že Hafnio predstavuje pyroporicitu, jedinú vlastnosť, ktorá znamená oheň alebo vážne popáleniny riziká.

