Hydroxylová skupina

- 982
- 253
- Gabriel Bahna
Vysvetľujeme, čo je hydroxylová skupina, jej charakteristiky, štruktúra a niekoľko príkladov
 Chemická štruktúra hydroxylovej skupiny
Chemická štruktúra hydroxylovej skupiny Čo je hydroxylová skupina?
A Hydroxylová skupina Je to funkčná skupina alebo časť iných funkčných skupín prítomných v mnohých organických a anorganických zlúčeninách. Tvorí sa atómom vodíka a jedným z kyslíka (odtiaľ jeho názov).
Hydroxylové skupiny sú zvyčajne spojené s atómom uhlíka alebo iným nemetalickým prvkom, ako je síra alebo fosfor, a sú jednou z najdôležitejších funkčných skupín v organickej chémii.
Táto skupina atómov je prítomná v organických funkčných skupinách, ako sú alkoholy, fenoly a karboxylové kyseliny, a je to tá, ktorá dáva každú z týchto funkčných skupín svoje chemické vlastnosti charakteristické charakteristické charakteristiky. V rôznych štruktúrach môže byť reprezentovaný ako -oh alebo ho-
Charakteristiky hydroxylových skupín
- Skladá sa z atómu kyslíka a jedného z vodíka spojeného so sebou a spojeným s iným atómom v molekule cez kovalentné väzby.
- Prepojenie medzi atómom vodíka a kyslíka je polárna väzba, v ktorej má kyslík negatívne čiastočné zaťaženie a kladné čiastočné zaťaženie vodíka, vďaka čomu je hydroxylová skupina polárnou funkčnou skupinou.
- Má štruktúru podobnú štruktúre vody. Z tohto dôvodu je mnoho zlúčenín, ktoré ho obsahujú, zvyčajne rozpustné v uvedenom rozpúšťadle.
- Má vodík priamo spojený s atómom kyslíka, takže hydroxylová skupina môže tvoriť vodíkovú väzbu, v ktorej sa zúčastňuje ako darcovská vodíková skupina.
- Hydroxylová skupina, ktorá má dva voľné elektróny na atóme kyslíka.
- Môžete pôsobiť ako kyselina tým, že dáte protón základne. V závislosti od funkčnej skupiny, ktorej je súčasťou, a atómu, s ktorým je priamo prepojená, môže hydroxylová skupina vykazovať rôzne úrovne kyslosti. Napríklad v alkoholoch má PKA 15 alebo viac (divoká kyselina ako voda), vo fenoloch sa pohybuje medzi 7 a 10, zatiaľ čo v karboxylových kyselinách je zvyčajne medzi 4 a 5.
- Môžete tiež pôsobiť ako základňa Lewis a darovať jeden z jeho párov elektrónov na prepojenie s iným protónom alebo iným Lewisovým kyselinou.
Štruktúra hydroxylovej skupiny
Ako je uvedené v charakteristikách, atómy kyslíka a vodíka v hydroxylovej skupine tvoria polárnu kovalentnú väzbu.
Okrem toho atóm kyslíka tvorí druhú kovalentnú väzbu s ďalším atómom, ktorý je súčasťou molekuly ako alkohol, fenol do nejakej inej zlúčeniny. Štruktúra Lewisu tejto skupiny je uvedená nižšie:
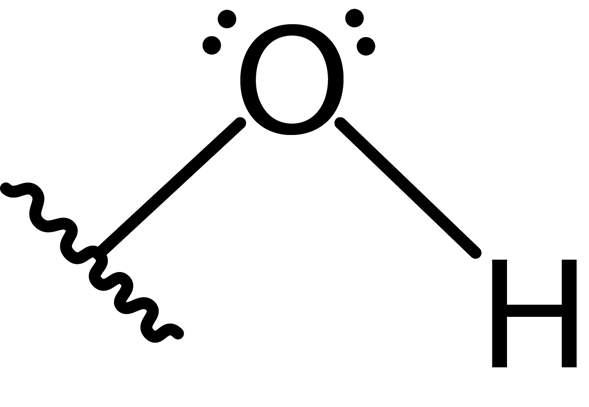
V dôsledku prítomnosti dvoch párov voľných elektrónov na atóme kyslíka a dvoch kovalentných väzieb má hydroxylová skupina uhlovú geometriu s uhlom približne 104 °, mierne nižšia ako tetraedrálny uhol. Dĺžka väzby kyslíka-hydrogén je okolo 0.97 Angstroms.
Hydroxylová skupina, hydroxyl radikál a anión hydroxidu
Je veľmi bežné zamieňať hydroxylovú skupinu s hydroxyl radikálnym a hydroxidovým aniónom, pretože všetky sú tvorené rovnakými dvoma atómami, tieto výrazy sa však netýkajú rovnakých.
Na jednej strane sa hydroxylové radikály líši od hydroxylovej skupiny, v ktorej je voľným radikálom s nepárnym počtom valenčných elektrónov, a tiež nie je spojený s iným atómom alebo skupinou atómov (preto sa hovorí, že je to zadarmo).
Napriek týmto rozdielom veľa ľudí chybne používa hydroxyl radikálny termín na označenie hydroxylovej skupiny, keď sú prítomné v molekule.
Na druhej strane anión hydroxidu je ión s negatívnou záťažou tvorenou vodíkom a kyslíkom, zatiaľ čo hydroxylová skupina je neutrálna skupina.
Okrem toho, zatiaľ čo hydroxylová skupina je vždy spojená s molekulou pomocou kovalentnej väzby, zlúčeniny, ktoré obsahujú hydroxidové ióny.
Môže vám slúžiť: Čo sú anóda a katóda?Príklady hydroxylovej skupiny
Alkoholy
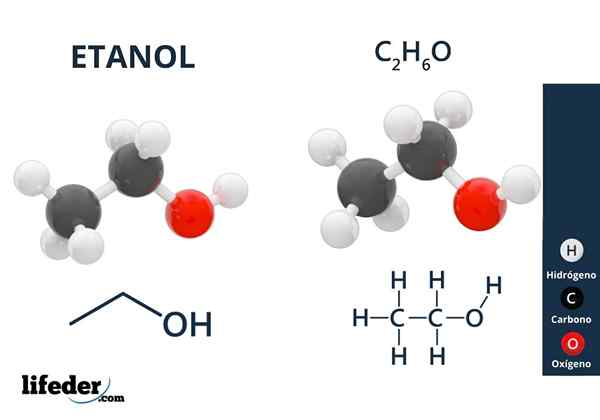 Etanol
Etanol Alkoholy majú hydroxylové skupiny spojené s alifatickým uhlíkom. Príklady alkoholov sú:
- Metodylalkohol.
- Etanol.
- Izopropylalkohol.
Fenoly
Fenoly sa vyznačujú tým, že majú hydroxylovú skupinu priamo spojenú s aromatickým krúžkom. Niektoré príklady bežných fenolov sú:
- Fenol.
- Alfa a beta-noftol.
- Ortho, cieľ a pre Cresol.
Uhľohydráty
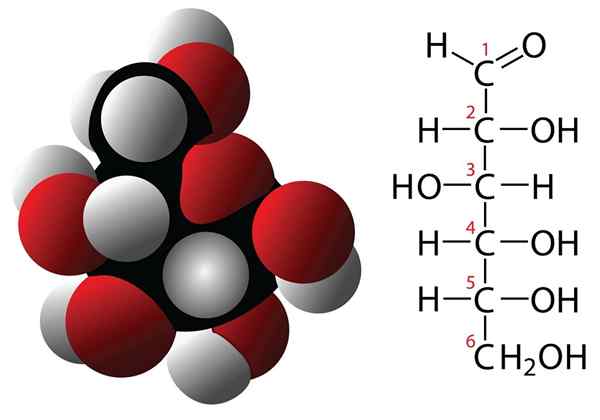 Glukóza a molekulárna vzorca
Glukóza a molekulárna vzorca Sacharidy sú zlúčeniny s 3 alebo viacerými atómami uhlíka, ktoré sa vyznačujú empirickým vzorcom tvoreným uhlíkmi a molekulami vody. Tieto zlúčeniny majú často viac skupín hydroxilli, vďaka ktorým sú veľmi rozpustné vo vode. Niektoré príklady uhľohydrátov sú:
- Glukóza.
- Fruktóza.
- Sacharóza.
Karboxylové kyseliny
Karboxylová funkčná skupina prítomná v karboxylových kyselinách zodpovedá jednej z najkrajších funkčných skupín, ktoré môže mať organická molekula. Tieto zlúčeniny sú zvyčajne slabé kyseliny pri ich porovnaní s niektorými minerálnymi kyselinami, ale môžu sa stať značne kyslými v závislosti od ich štruktúry.
Kyslosť karboxylovej skupiny je spôsobená prítomnosťou hydroxylovej skupiny spojenej so skupinou karbonylovej skupiny, ktorá stabilizuje negatívne zaťaženie aniónu, ktorý sa tvorí, keď hydroxyl poskytne svoj protón. Niektoré príklady karboxylových kyselín sú:
- Octová kyselina.
- Kyselina benzoová.
- Kyselina trifluóroctová.
Kyseliny sulfónovej
Kyseliny sulfónovej sú organické zlúčeniny, ktoré sú tvorené reakciou medzi niektorými organickými zlúčeninami a kyselinou sírovou alebo oxidom siričitého. Tieto typy zlúčenín majú hydroxylovú skupinu a vo všeobecnosti sú pomerne silné kyseliny, porovnateľné s kyselinou sírovou.
Niektoré príklady kyselín sulfónovej sú:
- Kyselina pentosulfónová.
- Ortho, cieľa a izoméry kyseliny toluensulfónovej.
- Kyselina benzeulfónová.
Anorganické kyseliny
Hydroxylové skupiny sa objavujú nielen v organických zlúčeninách. Mnoho anorganických zlúčenín ich má tiež, najmä oxacidné kyseliny. V týchto prípadoch je hydroxylová skupina priamo spojená s net -kmetom, zvyčajne odlišným od uhlíka.
Niektoré príklady anorganických kyselín, ktoré majú hydroxylové skupiny spolu s net -metal, s ktorými je prepojený, sú:
- Hypochlorousová kyselina, v ktorej je hydroxylová skupina spojená s atómom chlóru.
- Kyselina sírová, ktorá má dve hydroxylové skupiny spojené s atómom síry.
- Kyselina fosforečná, v ktorej sú tri hydroxylové skupiny spojené s atómom fosforu.

