Charakteristiky karbonylovej skupiny, vlastnosti, nomenklatúra, reaktivita
- 1425
- 187
- Ing. Ervín Petruška
On Karbonylová skupina Je to organická a okysličená funkčná skupina, ktorá pripomína molekulu plynu oxidu uhoľnatého. Je znázornený ako C = O, a hoci sa považuje za organický, možno ho nájsť aj v anorganických zlúčeninách; Rovnako ako kyselina uhličitá, h2Co3, alebo v organometalických zlúčeninách s CO ako väzbou.
Je to však v chémii uhlíka, života, biochémii a ďalších analogických vedeckých odvetviach, kde táto skupina vyniká svojím obrovským významom. Keby to nebolo pre neho, mnoho molekúl nemohlo interagovať s vodou; Proteíny, cukry, aminokyseliny, tuky, nukleové kyseliny a iné biomolekuly by neexistovali, ak by to nebolo.
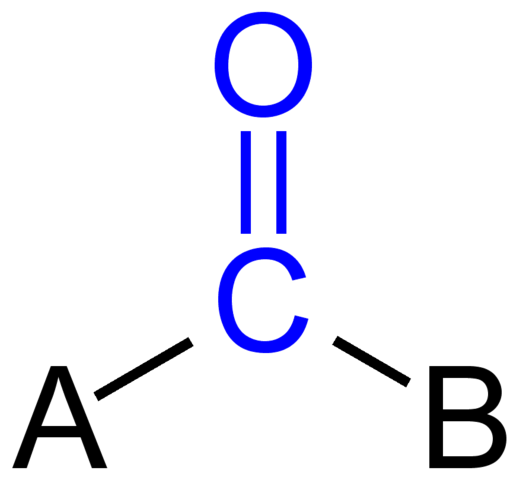
 Karbonylová skupina. Zdroj: Jü [verejná doména]
Karbonylová skupina. Zdroj: Jü [verejná doména] Horný obrázok ukazuje, ako táto skupina vyzerá vo všeobecnej kostre zlúčeniny. Všimnite si, že je zvýraznená modrou farbou a ak by sme odstránili výmeny A a B (R alebo R ', rovnako platné), bola by tu molekula oxidu uhoľnatého. Prítomnosť týchto substituentov definuje veľké množstvo organických molekúl.
Ak sú A a B atómy uhlíka, ako sú kovy alebo nemetalické prvky, môžu sa vyrobiť organometalické alebo anorganické zlúčeniny. V prípade organickej chémie budú substituenty A a B vždy alebo vodíkové atómy, sýtené vedenia, s alebo bez dôsledkov, cyklických alebo aromatických krúžkov.
Preto začína chápať, prečo je karbonylová skupina celkom bežná pre tých, ktorí študujú prírodné alebo zdravotné vedy; Je všade a bez neho by sa molekulárne mechanizmy, ktoré sa v našich bunkách vyskytujú.
Ak by sa jeho relevantnosť mohla zhrnúť, hovorí by sa, že poskytuje polaritu, kyslosť a reaktivitu na molekulu. Tam, kde existuje karbonylová skupina, je viac ako pravdepodobné, že práve v tomto bode môže molekula utrpieť transformáciu. Preto je strategickým miestom na vývoj organickej syntézy prostredníctvom oxidácií alebo nukleofilných útokov.
[TOC]
Charakteristiky a vlastnosti skupiny karbonylovej skupiny
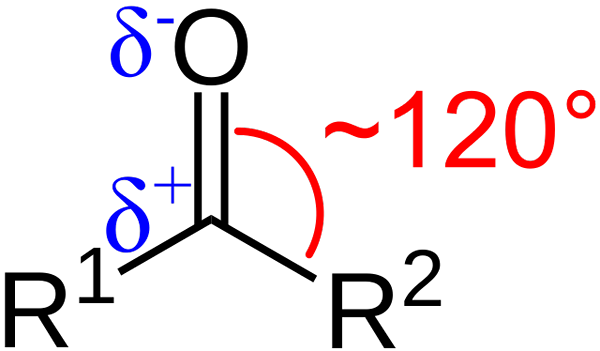 Štrukturálne charakteristiky karbonylovej skupiny. Zdroj: Azaline Gomberg [verejná doména].
Štrukturálne charakteristiky karbonylovej skupiny. Zdroj: Azaline Gomberg [verejná doména]. Aké sú štrukturálne a elektronické charakteristiky karbonylovej skupiny? Nahor1 a r2 Namiesto A a B, ktorý existuje medzi substituentmi a atómom kyslíka, uhol 120 ° C; To znamená, že geometria v tejto skupine je trigonálny byt.
Čo je to geometria2; Uhlík teda bude mať tri orbitály SP2 Vytvorenie jednoduchých kovalentných odkazov s R1 a r2, a orbitál p čistý na vytvorenie dvojitej väzby s kyslíkom.
Týmto spôsobom sa vysvetľuje, ako môže existovať dvojitá väzba c = o.
Ak je obrázok pozorovaný, bude tiež zrejmé, že kyslík má väčšiu elektronickú hustotu, δ-, ako uhlík, δ+. Je to preto, že kyslík je viac elektronegatívny ako uhlík, a preto „ukradne“ elektronickú hustotu; A nielen pre neho, ale aj pre substituentov r1 a r2.
V dôsledku. Kde je karbonylová skupina, budú dipólové momenty.
Rezonančné štruktúry
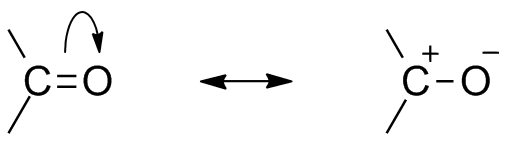 Dve rezonančné štruktúry pre túto organickú skupinu. Zdroj: Mfomich [CC0]
Dve rezonančné štruktúry pre túto organickú skupinu. Zdroj: Mfomich [CC0] Ďalším dôsledkom elektronegativity kyslíka je to, že v karbonylovej skupine existujú rezonančné štruktúry, ktoré definujú hybrid (kombinácia týchto dvoch štruktúr vynikajúceho obrazu). Všimnite si, že elektrónový pár môže migrovať do orbitálu p kyslíka, ktorý zanecháva atóm uhlíka s pozitívnou čiastočnou zaťažením; Karbocation.
Môže vám slúžiť: cykloalcanos: vlastnosti, reakcie, použitia, príkladyObe štruktúry sa stávajú neustále, takže uhlík udržuje konštantný nedostatok elektrónov; To znamená, že pre katióny, ktoré sú veľmi blízko, zažijú elektrostatický odpor. Ale ak je to anión alebo druh schopný darovať elektróny, bude pre tento uhlík pociťovať silnú príťažlivosť.
Potom sa vyskytuje to, čo sa nazýva nukleofilný útok, ktorý bude vysvetlený v ďalšej časti.
Menovanie
Keď má zlúčenina skupinu C = o, hovorí sa, že je karbonyl. V závislosti od povahy karbonylovej zlúčeniny má teda svoje vlastné pravidlá nomenklatúry.
Aj keď, bez ohľadu na to, čo je, každý zdieľa pravidlo spoločné: C = O má prioritu v reťazci sýteného sýtu.
To znamená, že ak existujú dôsledky, atómy halogénu, nitrogénne funkčné skupiny, dvojité alebo trojité odkazy, žiadna z nich nemôže niesť menšie číslo ako C = o; Preto najdlhší reťazec sa začína uviesť čo najbližšie k karbonylovej skupine.
Ak je naopak, je niekoľko C = alebo v reťazci a jedna z nich je súčasťou funkčnej skupiny väčšej hierarchie, potom karbonylová skupina bude mať väčšie lokalizátor a bude uvedená ako substituent OXO.
A čo sa hovorí hierarchia? Nasledujúce, od najvyššieho po maloleté:
-Karboxylové kyseliny, RCOOH
-Ester, rCoor '
-Amida, rconh2
-Aldehyd, rCOH (alebo rcho)
-Cetona, Rcor
Nahradenie r a r 'molekulárnymi segmentmi, nekonečné karbonylové zlúčeniny predstavované nad rodinami vyššie: karboxylové kyseliny, estery, Amidas atď. Každý z nich pridal svoju tradičnú nomenklatúru alebo IUPAC.
Reaktivita
Nukleofilný útok
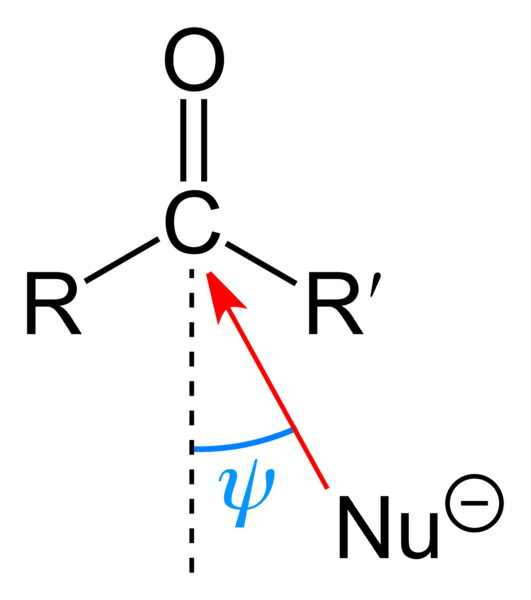 Nukleofilný útok na karbonylovú skupinu. Zdroj: Benjah-Bmm27 [verejná doména]
Nukleofilný útok na karbonylovú skupinu. Zdroj: Benjah-Bmm27 [verejná doména] Horný obrázok ukazuje nukleofilný útok, ktorý utrpel karbonylová skupina. Nukleofil, nu-, Môže to byť anión alebo neutrálny druh s dostupnými elektrónmi; Rovnako ako amoniak, NH3, Napríklad. Vyzerá to výlučne na uhlík, pretože podľa rezonančných štruktúr predstavuje pozitívne čiastočné zaťaženie.
Pozitívne zaťaženie priťahuje nu-, ktoré sa budú snažiť priblížiť sa k „boku“ tak, že substituenty R a R 'existuje najmenšia stérická prekážka substituentov R a R'. V závislosti od toho, aké objemné sú, alebo veľkosť toho istého nu-, Útok nastane v rôznych uhloch ψ; Môže byť veľmi otvorený alebo zatvorený.
Akonáhle sa útok stane, vytvorí sa sprostredkovateľská zlúčenina, nu-cr'-o-; to znamená, že kyslík zostáva s niekoľkými elektrónmi, aby sa umožnilo pridanie NU- do karbonylovej skupiny.
Tento negatívne načítaný kyslík môže zasiahnuť do iných krokov reakcie; Protón ako hydroxylová skupina, OH alebo sa uvoľňuje ako molekula vody.
Môže vám slúžiť: Oddielový koeficient: distribúcia, distribúcia, aplikácieZúčastnené mechanizmy, ako aj produkty reakcie získanej týmto útokom, sú veľmi rozmanité.
Deriváty
Nublyic agent NU- Môže to byť veľa druhov. Pre každý špecifický na reakciu v skupine karbonylových skupín, rôzne deriváty.
Napríklad, keď je uvedené nukleofilným činidlom, je amín, NH2A, IMinas pôvod, r2C = nr; Ak je to hydroxylamín, NH2Och, vedie k oximám, rr'c = noh; Ak je to anión kyanidu, CN-, Cianohydrinas, RR'C (OH) CN, a teda s inými druhmi.
Zníženie
Spočiatku sa hovorilo, že táto skupina je okysličená, a preto hrdzavá. To znamená, že za podmienok je možné odkazy znížiť alebo stratiť atóm kyslíka, ktorý ho nahrádza hydrogénmi. Napríklad:
C = o => ch2
Táto transformácia naznačuje, že karbonylová skupina sa znížila na skupinu metylénu; V dôsledku straty kyslíka došlo k zisku vodíka. Vhodnejšie chemické vyjadrenie: Karbonylová zlúčenina sa redukuje na alkán.
Ak je to Cetona, rcor ', v prítomnosti hydraraciny, h2N-nh2, a silne základné prostredie možno znížiť na jeho príslušný alkán; Táto reakcia je známa ako redukcia Wolff-Kishner:
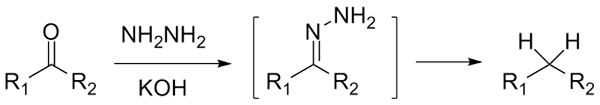 Zníženie Wolff-Kishnera. Zdroj: Jü [CC0]
Zníženie Wolff-Kishnera. Zdroj: Jü [CC0] Ak na druhej strane reakčná zmes pozostáva z amalgamátu zinku a kyseliny chlorovodíkovej, reakcia je známa ako Clemmensenov redukcia:
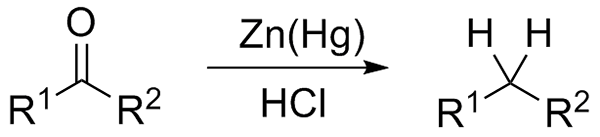 Zníženie Clemmensen. Zdroj: Wikimedia Commons.
Zníženie Clemmensen. Zdroj: Wikimedia Commons.
Acetal and Ceal Training
Karbonylová skupina nemôže nielen pridať nukleofilné látky NU-, ale v kyslých podmienkach môže tiež reagovať s alkoholmi podobnými mechanizmami.
Keď aldehyd alebo cetona čiastočne reagujú s alkoholom, hemiacetami alebo hemicetálmi, v danom poradí, respektíve. Ak sa reakcia vykonáva úplne, výrobky sú acetály a ketály. Nasledujúce chemické rovnice sumarizujú a objasňujú novo spomenuté:
Rcho + r3Oh g rchoh (alebo3) (Hemiacetál) + r4Oh g rch (alebo3) (Alebo4) (Acetal)
Rcor2 + R3Ach g rcor2(Oh) (alebo3) (Hemické) + r4Ach g rcor2(Alebo3) (Alebo4) (ketal)
Prvá reakcia zodpovedá tvorbe hemiacetálov a acetálov z aldehydu a druhá z hemicetálov a ketálov z ketónu.
Tieto rovnice nie sú dostatočne jednoduché na vysvetlenie tvorby týchto zlúčenín; Avšak pre prvý prístup k subjektu stačí pochopiť, že sa pridávajú alkoholy a že ich bočné reťazce R (r (r (r (r3 a r4) Sú spojené s karbonyl uhlíkom. Preto alebo alebo3 a alebo4 Do počiatočnej molekuly.
Hlavný rozdiel medzi acetálom a ketálom je prítomnosť atómu vodíka spojeného s uhlíkom. Všimnite si, že ketón chýba tento vodík.
Chlapci
Veľmi podobné, ako je vysvetlené v sekcii nomenklatúry pre karbonylovú skupinu, jej typy sú založené na tom, čo sú substituenty A a B alebo R a R '. Preto existujú štrukturálne charakteristiky, ktoré zdieľajú sériu karbonylových zlúčenín nad rámec poradia alebo typu odkazov.
Napríklad sa spomenula na princípe analógie medzi touto skupinou a oxidom uhoľnatým, C≡o. Ak je molekula bez atómov vodíka a ak existujú aj dva c = o terminály, potom to bude oxid uhličitý, cnAni2. Pre n sa rovná 3, budete mať:
Môže vám slúžiť: IsóbarosO = c = c = c = o
Čo je, akoby existovali dve molekuly C≡o spojené a oddelené uhlíkom.
Karbonylové zlúčeniny môžu nielen odvodiť plyn Co, ale aj z kyseliny uhličitej, h2Co3 alebo OH- (c = o) -oh. Tu dva OH predstavujú R a R 'a nahradia sa jednej z nich, alebo ich hydrogény, získajú sa deriváty kyseliny uhlíkovej kyseliny.
A potom sú tu deriváty karboxylových kyselín, RCOOH, získané zmenou identity R alebo výmenou H iným atómom alebo reťazcom R '(čo by viedlo k esteru, RCOOR').
Ako to identifikovať v aldehydosoch a ketónoch
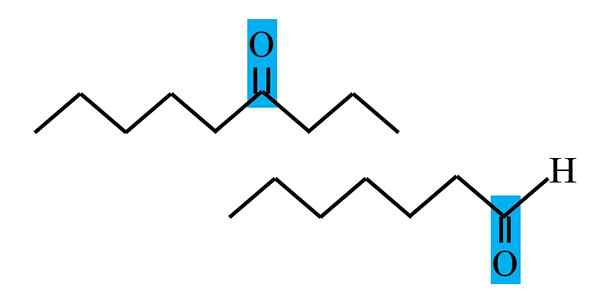 Diferenciácia ketónu a aldehydu od štrukturálneho vzorca. Zdroj: Gabriel Bolívar.
Diferenciácia ketónu a aldehydu od štrukturálneho vzorca. Zdroj: Gabriel Bolívar. Aldehydos aj ketóny majú spoločnú prítomnosť karbonylovej skupiny. Jeho chemické a fyzikálne vlastnosti sú spôsobené tým. Ich molekulárne prostredie však nie sú rovnaké v oboch zlúčeninách; V prvom mieste je v terminálovej polohe av sekundách kdekoľvek v reťazci.
Napríklad na hornom obrázku je karbonylová skupina vo vnútri modro. V ketónoch musí vedľa tejto škatule existovať ďalší segment uhlíka alebo reťazca (hore nohami); Zatiaľ čo v aldehydoch môže byť iba atóm vodíka (nižšie).
Ak je C = o na jednom konci reťazca, bude to aldehyd; To je najpriamejší spôsob, ako ho odlíšiť od Cetony.
Id
Ale ako sa experimentálne poznať, ak je neznáma zlúčenina aldehyd alebo ketón? Existuje mnoho metód, zo spektroskopických (infračervené absorpcie žiarenia, IR) alebo organických kvalitatívnych testov.
Pokiaľ ide o kvalitatívne eseje, sú založené na reakciách, že pri pozitívnych analytikoch bude analytik pozorovať fyzickú reakciu; Zmena farby, uvoľňovanie tepla, tvorba bublín atď.
Napríklad pridanie do vzorky kyslý roztok k2Cr2Ani7 Aldehyd sa transformuje na kyselinu karboxylovú, čo spôsobuje, že farba roztoku sa mení z oranžovej na zelenú (pozitívny test). Medzitým ketóny nereagujú, a preto analytik nepozoruje žiadnu zmenu farby (negatívny test).
Ďalším pokusom je použitie Tollens Reagent, [AG (NH3)2]+, aby aldehyd znižoval katióny ag+ na kovové striebro. A výsledok: tvorba strieborného zrkadla na spodnej časti skúmavky, kde bola vzorka umiestnená.
Hlavné príklady
Nakoniec bude uvedená séria príkladov karbonylových zlúčenín:
-Chvály3COOH, kyselina octová
-HCOOH, kyselina mravčová
-Chvály3Cocha3, Propanona
-Chvály3Cocha2Chvály3, 2-butanón
-C6H5Cocha3, acetofenón
-Chvály3Cho, etanal
-Chvály3Chvály2Chvály2Chvály2Cho, Pentanal
-C6H5Cho, benzaldehyd
-Chvály3Conh2, acetamid
-Chvály3Chvály2Chvály2Kočiary3, Propylacetát
Teraz, ak sú uvedené príklady zlúčenín, ktoré jednoducho vlastnia túto skupinu, zoznam by bol takmer nekonečný.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Reid Danielle. (2019). Karbonylová skupina: Vlastnosti a prehľad. Štúdium. Získané z: štúdie.com
- Sharleen Agvateesiri. (5. júna 2019). Karbonylová skupina. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Wiki Kids Ltd. (2018). Zlúčeniny. Obnovené z: jednoducho.Veda
- Tobolka. (s.F.). Nomenklatúra a štruktúra karbonylovej skupiny. Získané z: Toppr.com
- Clark J. (2015). Oxidácia aldehydov a ketónov. Získané z: Chemguide.co.Uk

