Vlastnosti plynov, správanie, forma, príklady

- 1646
- 453
- Ing. Ervín Petruška
Ten Plyny Sú to všetky tie látky alebo zlúčeniny, ktorých agregačné stavy sú slabé a rozptýlené, zatiaľ čo v závislosti od tlakových a teplotných podmienok, ktoré ich riadia. Možno predstavuje druhú formu hmoty hojnejšiu v celom vesmíre po plazme.
Na zemi plyny tvoria vrstvy atmosféry, od exosféry, po troposféru a vzduch, ktorý dýchame. Aj keď je plyn neviditeľný, keď je šírený veľkými priestormi, ako je napríklad obloha, je detekovaný pohybom mrakov, zákrut lopatiek mlyna alebo vydýchnutými výparmi našich úst v chladnom podnebí.
 Plyny sa dajú pozorovať v priemyselných alebo domácich komínoch, ako aj v dymových vežiach vychádzajúcich sopkami. Zdroj: pxhere.
Plyny sa dajú pozorovať v priemyselných alebo domácich komínoch, ako aj v dymových vežiach vychádzajúcich sopkami. Zdroj: pxhere. Podobne, chodenie do environmentálnych negatívnych aspektov, sa pozoruje v čiernom dyme výfukového potrubia vozidiel, v dymových stĺpcoch veží nachádzajúcich sa v továrňach alebo v dyme zdvihnutého, keď les spáli.
Čelí tiež plynným javom, keď sú vidieť výpary, ktoré opúšťajú kanalizácie, v osudových požiaroch močiaru a cintorínov, v bubbovom kyslíku uvoľňovanom rastlinami produktom ich fotosyntézy a dokonca aj v erutách a plynatosti.
Kdekoľvek sa pozorujú plyny, znamená to, že došlo k chemickej reakcii, pokiaľ nie sú pevné alebo asimilované priamo zo vzduchu, hlavný zdroj plynov (povrchne) planéty. Keď sa teploty zvyšujú, každá látka (chemické prvky) sa transformuje na plyny vrátane kovov, ako je železo, zlato a striebro.
Bez ohľadu na chemickú povahu plynov, každý zdieľa spoločnú vzdialenosť, ktorá oddeľuje ich častice (atómy, molekuly, ióny atď.), ktoré sa pohybujú chaotické a svojvoľne podľa konkrétneho objemu alebo priestoru.
[TOC]
Plynné vlastnosti
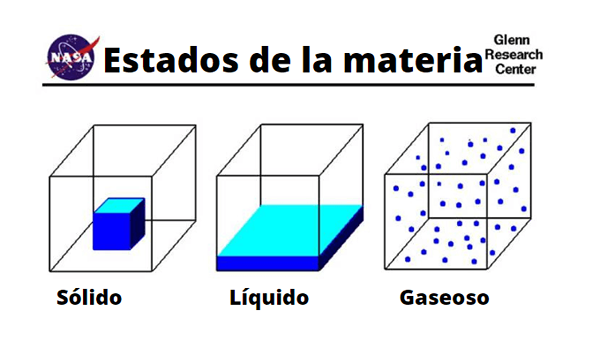 Rozdiely v molekulách tuhých, tekutín a plynu
Rozdiely v molekulách tuhých, tekutín a plynu Fyzický
Fyzikálne vlastnosti plynov sa líšia v závislosti od toho, čo je látka alebo zlúčenina. Populárne plyny sú spojené so zlými zápachmi alebo hnilobou kvôli obsahu síry alebo z prítomnosti prchavých amínov. Podobne sú vizualizované zelenými, hnedými alebo žltkastými sfarbeniami, ktoré zastrašujú a dávajú zlé znamenie.
Väčšina plynov, alebo aspoň najčastejšie, je však vlastne bezfarebná a bez zápachu. Aj keď sú nenápadné, môžu sa cítiť na pokožke a sú proti odporu pohybu, dokonca aj vytvárajú viskózne vrstvy v telách, ktoré ich prechádzajú (ako v prípade lietadiel).
Všetky plyny môžu zaznamenať zmeny tlaku alebo teploty, ktoré nakoniec vytvárajú svoje príslušné kvapaliny; to znamená, že trpia kondenzáciou (ak sú ochladené) alebo skvapalnením (ak sú „stlačené“).
 Kondenzácia; plynného stavu do tekutého stavu
Kondenzácia; plynného stavu do tekutého stavu Na druhej strane, plyny sú schopné rozpúšťať sa v kvapalinách a niektorých poréznych tuhých látkach (napríklad aktívny uhlie). Bubliny sú výsledkom zhlukov plynov, ktoré sa ešte nerozpustili v strede a unikli na kvapalný povrch.
Elektrická a tepelná vodivosť
Za normálnych podmienok (bez ionizácie ich častíc) sú plyny zlými vodičmi tepla a elektriny. Keď sú však napäté s mnohými elektrónmi, umožňujú ich priechod prúdu cez ne, ako je vidieť v lúčoch počas búrok.
Na druhej strane, pri nízkych tlakoch a podrobených elektrickému poľu lampy na pouličných lucernach.
Môže vám slúžiť: Granataria Rovnováha: Charakteristiky, časti a ako ich používaťPokiaľ ide o tepelnú vodivosť, veľa plynov sa správajú ako tepelné izolátory, takže ich začlenenie do plnenia vlákien, tkanív alebo sklenených panelov pomáha zabrániť tomu, aby sa ich teplo uvarilo a udržali konštantnú teplotu konštantnú.
Existujú však plyny, ktoré sú dobrými tepelnými vodičmi a môžu spôsobiť horšie popáleniny spôsobené tekutinou alebo tuhými látkami; Napríklad, rovnako ako v prípade horúcej pary pečených koláčov (alebo empanadas) alebo s parnými tryskami, ktoré unikajú z kotlov.
Reaktivita
Všeobecne sú reakcie týkajúce sa plynov alebo tam, kde sa vyskytujú, sú opísané ako nebezpečné a ťažkopádne.
Jeho reaktivita opäť závisí od ich chemickej povahy; Pri veľkej miere rozširovania a mobilizácie sa však musí venovať väčšia starostlivosť a kontrola, pretože môžu vyvolať drastický tlak, ktorý ohrozuje štruktúru reaktora; Nehovoriac o tom, ako horľavé alebo nie sú šťastné plyny.
Plynovanie
Makroskopicky je možné dať predstavu o správaní plynov tým, že je svedkom toho, ako sa vo vzduchu vyvíja dym, krúžky alebo literárne „jazyky“ cigariet vo vzduchu. Tiež, keď dymový granát exploduje, je zaujímavé podrobne opísať pohyb týchto oblakov rôznych farieb.

Takéto pozorovania sa však podliehajú pôsobeniu vzduchu a tiež skutočnosťou, že v dyme sú veľmi jemné tuhé častice zavesené. Preto tieto príklady nestačia na dosiahnutie záveru, pokiaľ ide o skutočné správanie plynu. Namiesto toho sa uskutočňovali experimenty a vyvinuli sa kinetická teória plynov.
Molekulárne a ideálne, plynné častice sa elasticky zrážajú navzájom, majú lineárne, rotačné a vibračné posuny. Majú priemernú pridruženú energiu, ktorá jej umožňuje voľne cestovať do akéhokoľvek priestoru bez takmer interakcie alebo zrážania sa s inou časticou, keď sa objem zvyšuje okolo nich.
Jeho správanie by bolo zmesou Brownovho nevyspytateľného hnutia a zrážok biliardových guličiek, ktoré sa neustále odrážajú navzájom a steny stola; Ak neexistujú žiadne steny, rozšíri sa do nekonečna, pokiaľ si ich nezachovávajú: gravitácia.
Tvarovanie
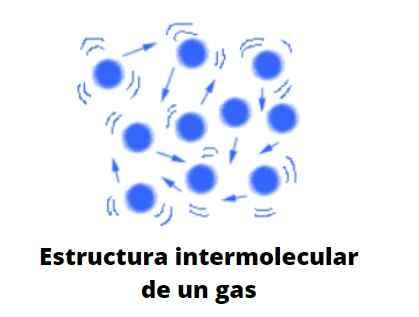
Plyny, na rozdiel od tekutín a tuhých látok, nepodliehajú kondenzovanému typu; to znamená, že agregácia alebo súdržnosť ich častíc nikdy nedokáže definovať formu. Zdieľajú s tekutkami skutočnosť, že úplne zaberajú objem kontajnera, ktorý ich obsahuje; Chýbajú však povrchové a povrchové napätie.
Ak je koncentrácia plynu vysoká, vaše „jazyky“ alebo už opísané makroskopické formy sa dajú vizualizovať voľným okom. Tieto, skôr alebo neskôr, skončí vyblednutie v dôsledku pôsobenia vetra alebo iba rozšírením plynu. Plyny preto pokrývajú všetky rohy obmedzeného priestoru spôsobujúce vysoko homogénne systémy.
Teraz táto teória pohodlne považuje plyny za gule, ktoré sotva zrážajú so sebou; Ale keď tak urobia, odrazia sa elasticky.
Tieto gule sú od seba veľmi oddelené, takže plyny sú prakticky „plné“ vákua; Odtiaľ dlžíte svoju všestrannosť, aby ste prekročili najmenšiu štrbinu alebo trhlinu a ľahkosť ich výrazne komprimovať.
Môže vám slúžiť: nemetalické oxidyPreto, avšak uzavretie inštalácie pekárne, ak chôdza po boku, je isté, že vôňa čerstvo upečeného chleba sa bude tešiť.
Tlak na plyn
Dalo by sa veriť, že tak, že sú tak rozptýlení a oddeľovaní plynových guľôčok alebo častíc, nie sú schopné generovať žiadny tlak na telá alebo predmety. Atmosféra však ukazuje, že takáto viera je nepravdivá: má hmotnosť, váži a zabraňuje odpareniu alebo vareniu tekutín z ničoho. Body varu sa meria pri atmosférickom tlaku.
Gase Tlak sa stávajú kvantifikovateľnejšími, ak sú k dispozícii manometre, alebo ak sú uzamknuté z neformovateľných nádob na stene. Čím viac častíc plynu je vo vnútri nádoby, tým väčší je počet kolízií medzi nimi a stenami rovnakých.
Tieto častice pri zrážke so stenami ich stlačia, pretože na svoj povrch majú silu úmernú svojej kinetickej energii. Je to, akoby boli ohromené ideálne biliardové gule na stenu; Ak je ich veľa, ktoré ich ovplyvňujú vysokou rýchlosťou, mohlo by sa zlomiť.
Jednotky
Existuje veľa jednotiek, ktoré sprevádzajú merania tlaku plynu. Niektoré z najznámejších sú milimetre ortuti (MMHG), ako aj torr. Sú to medzinárodný systém jednotiek (SI), ktoré definujú Pascal (PA) z hľadiska N/M2; A z neho, kilo (kPa), mega (MPA) a giga (GPA) Pascal.
Objem plynu
Plyn zaberá a rozširuje sa v objeme nádoby. Čím väčší je kontajner, bude tiež objem plynu; Ale ich tlak aj hustota sa znížia pre rovnaké množstvo častíc.
Samotný plyn má na druhej strane súvisiaci objem, ktorý tak nezávisí od jeho molekulárnej povahy alebo štruktúry (v ideálnom prípade), ale od tlakových a teplotných podmienok, ktoré ho riadia; To znamená, jeho molárny objem.
V skutočnosti sa molárny objem líši od jedného plynu k druhému, hoci variácie sú malé, ak nie sú heterogénne a veľké molekuly. Napríklad molárny objem amoniaku (NH3, 22 079 l/mol) pri 0 ° C a 1 atm, líši sa od hélia (He, 22 435 l/mol).
Všetky plyny majú molárny objem, ktorý sa mení v závislosti od P a T, a bez ohľadu na to, aké veľké sú ich častice, ich počet je vždy rovnaký. Odtiaľ odvodil to, čo je známe podľa čísla Avogadro (nDo).
Hlavné zákony plynov
Správanie plynu sa od minulých storočí študuje prostredníctvom experimentov, hlbokých pozorovaní a interpretácie výsledkov.
Takéto experimenty umožnili sériu zákonov, ktoré sa zhromaždili v tej istej rovnici (istých plynov), pomáhajú predpovedať reakcie plynu na rôzne tlakové a teplotné podmienky. Týmto spôsobom existuje vzťah medzi jeho objemom, teplotou a tlakom, ako aj počtom ich krtkov v určitom systéme.
Medzi tieto zákony patria nasledujúce štyri: Boyle, Charles, Gay-Lussac a Avogadro.
Boyle zákon
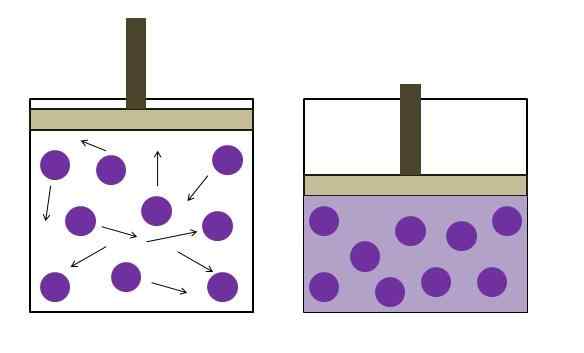 Zvýšený tlak na zníženie tlaku. Zdroj: Gabriel Bolívar
Zvýšený tlak na zníženie tlaku. Zdroj: Gabriel Bolívar Boyleov zákon stanovuje, že pri konštantnej teplote je objem ideálneho plynu nepriamo úmerný jeho tlaku; To znamená, že čím väčší je kontajner, tým nižší je tlak, ktorý zažije jeho steny o rovnaké množstvo plynu, zažije.
Môže vám slúžiť: Charlesov zákon: vzorce a jednotky, experiment, cvičeniaCharles zákon
 Čínske lucerny alebo želania. Zdroj: pxhere.
Čínske lucerny alebo želania. Zdroj: pxhere. Charlesov zákon ustanovuje, že pri konštantnom tlaku je objem ideálneho plynu priamo úmerný jeho teplote. Balóny demonštrujú Charlesa.
Zákon
Zákon Gay-Lussac ustanovuje, že pri konštantnom objeme je tlak ideálneho plynu priamo úmerný jeho teplote. V dobre prečlenom kotle, ak sa plyn postupne zahreje, zakaždým, keď bude tlak vo vnútri väčší, pretože steny kotla nie sú deformované alebo rozširované; To znamená, že jeho objem sa nemení, je konštantný.
Avogadro zákon
Nakoniec Avogadroov zákon ustanovuje, že objem obsadený ideálnym plynom je priamo úmerný počtu jeho častíc. Je to teda, ak máte mol častíc (6,02,1023), potom bude molárny objem plynu.
Typy plynov
Horľavé plyny
Sú to plyny, ktorých komponenty fungujú ako palivá, pretože sa používajú na výrobu tepelnej energie. Niektoré z nich sú zemný plyn, skvapalnený olej a plynný vodík.
Priemyselné plyny
Sú to vyrábané plyny, ktoré sa predávajú verejnosti pre rôzne využitie a aplikácie, napríklad pre zdravotnícke sektory, potraviny, ochrana životného prostredia, metalurgia, chemický priemysel, bezpečnosť, bezpečnosť. Niektoré z týchto plynov sú okrem iného kyslíka, dusík, hélium, chlór, vodík, oxid uhoľnatý, propán, metán, oxid dusný.
Inertné plyny
Sú to tie plyny, ktoré za špecifických podmienok teploty a tlaku nevytvárajú žiadnu chemickú reakciu ani veľmi nízku. Sú to neón, argón, hélium, Kripton a Xenon. Používajú sa v chemických procesoch, v ktorých sú potrebné nereaktívne prvky.
Príklady plynných prvkov a zlúčenín
Aké sú plynné prvky periodickej tabuľky za pozemských podmienok?
Najprv máme vodík (H), ktorý tvorí h molekuly2. Nasleduje hélium (HE), ľahší šľachetný plyn; a potom dusík (N), kyslík (O) a fluorid (F). Tieto posledné tri tiež tvoria diatomické molekuly: n2, Ani2 a f2.
Potom, čo fluorid prichádza neón (NE), ušľachtilý plyn, ktorý sleduje hélium. Pod fluórom máme chlór (CL), vo forme molekúl CL2.
Potom máme zvyšok ušľachtilých plynov: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) a Oganeson (OG).
Preto sú celkom dvanásť plynných prvkov; jedenásť, ak vylúčime vysoko rádioaktívny a nestabilný oganeson.
Plynné zlúčeniny
Okrem plynných prvkov budú uvedené niektoré bežné plynné zlúčeniny:
-H2S, sulfid vodíka, zodpovedný za vôňu zhnitých vajíčok
-NH3, amoniak, ktorá prenikajúca aróma, ktorá je vnímaná v použitých mydlách
-Co2, Oxid uhličitý, skleníkový plyn
-Nie2, oxid dusíka
-Nie, oxid dusíka, plyn, ktorý sa veril extrémne toxický, ale hrá dôležitú úlohu v obehovom systéme
-SW3, Oxid síry
-C4H10, bután
-HCl, chlorid vodíka
-Ani3, ozón
-SF6, Hexafluoruro zo síry
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Vlastnosti plynov. Zdroj: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Plyn. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (5. decembra 2018). Plyny - všeobecné vlastnosti plynov. Zotavené z: Thoughtco.com
- Hodinky na zdravie mužov Harvard. (2019). Stav plynu. Získané z: zdravia.Harvard.Edu
- Editory chladenia elektroniky. (1. september 1998). Tepelná vodivosť plynov. Obnovené z: elektronického chladenia.com

