Jednotky iónová sila, ako ju vypočítať, príklady

- 1251
- 38
- JUDr. Rudolf Čapkovič
Ten iónová sila Je to spôsob, ako vyjadriť koncentráciu iónov v roztoku. Túto koncepciu zaviedli v roku 1922 Lewis a Randall pri práci na opise koeficientu chemickej aktivity.
Keď je koncentrácia iónov v roztoku vysoká, vytvára sa elektrostatická interakcia medzi opačnými iónmi; To znamená, že katióny a anióny sú výrazne priťahované, čo vedie k účinnej alebo skutočnej iónovej koncentrácii je menšia ako koncentrácia vypočítaná pre konkrétnu chemickú reakciu.
 Iónová sila morskej vody je vysoká, okolo 0.7, kvôli svojej veľkej koncentrácii rozpustených solí
Iónová sila morskej vody je vysoká, okolo 0.7, kvôli svojej veľkej koncentrácii rozpustených solí Z tohto dôvodu bola zavedená koncepcia chemickej aktivity ako účinná iónová koncentrácia roztoku, pričom chemická aktivita je produktom molarity roztoku koeficientom chemickej aktivity.
Tento koeficient má hodnotu blízko k jednotke (1) pre zriedené iónové roztoky a pre So -založené ideálne riešenia. Toto sú roztoky, v ktorých sa intermolekulárna interakcia medzi podobnými molekulami rovná roztoku medzi rôznymi molekulami.
Vytvorenie koncepcie iónovej sily prispelo k vysvetleniu odchýlok od ideálneho správania, pozorované v reálnych iónových riešeniach.
[TOC]
Jednotky iónovej sily
Iónová sila má ako jednotky móly/l (molarita) alebo móly/kg vody (molealita). Posledne menovaný sa odporúča v roztokoch, ktoré nie sú uvedené, ktoré sú charakterizované, pretože objemy ich zmesí nie sú úplne prísady.
To znamená napríklad nasledujúce: ak je zmiešané 0.5 litrov kvapaliny A a 0.5 litrov tekutiny B, výsledný objem tejto zmesi, sa nemusí nevyhnutne rovnať 1 litra, ale môže sa líšiť.
Iónová sila predstavuje symbol i.
Môže vám slúžiť: bután: Štruktúra, vlastnosti, použitia a rizikáAko vypočítať iónovú silu?
Na výpočet iónovej sily roztoku sa berie do úvahy koncentrácia všetkých iónov prítomných v roztoku, ako aj ich príslušné valencie.
Hodnota iónovej sily sa získa použitím nasledujúceho vzorca:
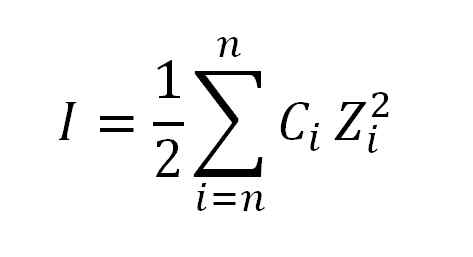 Vzorec použitý na výpočet iónovej sily. Zdroj: Gabriel Bolívar.
Vzorec použitý na výpočet iónovej sily. Zdroj: Gabriel Bolívar. Kde, ako som už povedal, je iónová sila; C, zodpovedá koncentrácii morálneho iónového alebo morálneho iónu; Zatiaľ čo z, predstavuje ich príslušné valencie (± 1, ± 2, ± 3 atď.).
Expresia, ktorá sa objaví vo vzorci pri výpočte iónovej sily (σ), sa číta ako zhrnutie, to znamená súčet produktu molárnej koncentrácie (C) každého iónu prítomného v roztoku podľa jeho valencie (z) vysoký druh.
Ako je vidieť, valencia iónu má najväčšiu váhu v hodnote iónovej sily roztoku. Napríklad: Valencia (z) CA je +2, takže z2 Je to rovnaké 4. Medzitým Valencia (z) Na es +1, a teda z2 Je to rovnaké 1.
To poukazuje na to, že prínos iónov CA2+ K hodnote iónovej sily, do tej istej koncentrácie molárnej iónovej, je štyrikrát väčšia ako hodnota NA iónu+.
Dôležitosť iónovej sily
Iónová sila je primeranou mierou iónovej koncentrácie roztoku a je základom stanovenia teórie Debye-Hückel. Táto teória popisuje ideálne správanie iónových riešení.
Iónová sila slúži ako základ pre výpočet koeficientu aktivity (yJo), parameter, ktorý zase umožňuje výpočet chemickej aktivity iónovej zlúčeniny, pričom chemická aktivita je účinná a skutočná koncentrácia iónovej zlúčeniny v roztoku.
Môže vám slúžiť: octaán z hliníka (AL (CH3COO) 3): Štruktúra, vlastnosti, použitiaZvýšením iónovej sily roztoku sa interakcia medzi iónmi zvyšuje. Preto zníženie γJo a chemická aktivita iónov.
Zvýšenie iónovej sily môže znížiť rozpustnosť proteínov vo vodnom prostredí, pričom táto vlastnosť sa používa na selektívne zrážky proteínov. Na zrážanie a čistenie plazmatických proteínov sa používajú roztoky sulfátu sulfátu s vysokou formou.
Príklady iónových síl
Príklad 1
Vypočítajte iónovú silu roztoku chloridu draselného (KCl) 0.3 m.
KCL sa disociuje nasledujúcim spôsobom:
KCL → K+ + Cl-
Máme dva ióny: K katión+ (Z =+1) a cl anión- (Z = -1). Potom použijeme vzorec na výpočet iónovej sily I:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Všimnite si, že Valencia -1 CL- Bol braný ako 1, jeho absolútna hodnota, pretože inak by sa iónová sila rovná 0.
Príklad 2
Vypočítajte iónovú silu roztoku sulfátu vápenatého (puzdro4) 0.5 m
Púzdro4 Disociuje sa takto:
Prípad4 → CA2+ + SW42-
Máme dva ióny: CA katión2+ (Z =+2) a anión SO42- (Z = -2). Potom použijeme vzorec na výpočet iónovej sily I:
I = 1/2 [C · (+2)2 + C · (-2)2]
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Príklad 3
Vypočítajte iónovú silu tlmiča nárazu s konečnými koncentráciami dibázického fosforečnanu sodného (Na2HPO4) 0.3 ma monobazický fosfát sodný (NAH2Po4) 0.4 m.
Potom2HPO4 Disociuje sa takto:
Môže vám slúžiť: Kyselina arzén (H3SO4): Vlastnosti, riziká a použitiaNat2HPO4 → 2+ + HPO42-
Zatiaľ čo nie2Po4 Disociuje sa nasledujúcim nasledujúcim vzorom:
Nie2Po4 → NA+ + H2Po4-
Postupujeme ako predchádzajúce cvičenia, tentokrát s aniónmi HPO42- (Z = -2) a h2Po4- (Z = -1):
I = 1/2 [C · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Všimnite si, že NA koncentrácia+ z NA2HPO4 Vynásobí sa 2, pretože jej koncentrácia je dvojnásobná. Avšak pre druhú soľ, nie2Po4, Koncentrácia NA+ Áno, znásobujeme ho 1 podľa stechiometrie jej rovnice rozpustenia.
Príklad 4
Vypočítajte iónovú silu roztoku chloridu sodného (NaCl) 0.15 ma glukóza (c6H12Ani6) 0.3 m.
NaCl sa disociuje takto:
NaCl → NA+ + Cl-
Glukóza však nie je disociovaná na iónoch, pretože má iba kovalentné väzby vo svojej chemickej štruktúre. Preto sa Valencia de la glukosa (z) rovná nule (0). Potom vypočítame produkt iónovej sily NaCl:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Iónová sila. Zdroj: In.Wikipedia.Alebo
- DR. David K. Ryž. (s.F.). Aktivita a iónová sila trieda 4 Ryan. [PDF]. Zdroj: Faculy.uMl.Edu
- Michiganská univerzita. (s.F.). Podrobnejší pohľad na chemickú rovnováhu. [PDF]. Uzdravený z: Umich.Edu
- Elsevier B.Vložka. (2020). Iónová sila. Vedecký. Zdroj: ScienceDirect.com
- C.D. Kennedy. (1990). Iónová stĺpka a sklápačka kyselín. [PDF]. Získané z: IUBMB.Online knižnica.Mravný.com

