História fosforu, vlastnosti, štruktúra, získanie, použitie

- 1077
- 6
- JUDr. Rudolf Čapkovič
On zápas Je to nemetalický prvok, ktorý predstavuje chemický symbol p a má atómové číslo 15. Predstavuje tri hlavné alotropné formy: biely, červený a čierny fosfor. Biely fosfor je fosforeskujúci, spaľuje spontánne, keď je vystavený vzduchu a je tiež veľmi jedovatý.
Biely fosfor pri 250 ° C teploty sa stáva červeným fosforom; polymérna forma, nerozpustná a ktorá nespáli vo vzduchu. Pri vysokých teplotách a tlakoch, ako aj v prítomnosti alebo nie katalyzátorov, sa získa čierny fosfor, ktorý sa podobá grafitu a je dobrým vodičom elektrickej energie.
 Biely fosfor uložený vo fľaši s vodou. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Biely fosfor uložený vo fľaši s vodou. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Fosfor bol prvýkrát izolovaný H. Značka, v roku 1669. Na to, moč sa používa ako zdroj tohto prvku. V roku 1770, w. Scheele zistil, že môže tiež izolovať kosti fosforu.
Následne kvôli vytvoreniu elektrickej rúry J. Burgess Readman (1800), fosfátové horniny sa stali hlavným zdrojom produkcie fosforu z fluórapatitovej rudy, prítomné v nich, prítomné.
Fosfor je dvanásť hojnejších prvkov zemskej kôry a predstavuje 0,1% podľa hmotnosti. Okrem toho je to šiesty prvok v hojnosti v ľudskom tele; Hlavne sústredené v kostiach vo forme hydroxylapatitu.
Je preto nevyhnutným prvkom pre živé bytosti a stáva sa jednou z troch hlavných živín rastlín. Fosfor je súčasťou chemickej štruktúry nukleových kyselín; zlúčenín na skladovanie energie (ATP), koenzýmy; a vo všeobecnosti zlúčeniny metabolizmu.
[TOC]
História
- Objavenie
Moč
 Joseph Wright of Derby Painting, kde ilustruje objav fosforu. Zdroj: Joseph Wright of Derby [Public Domain]
Joseph Wright of Derby Painting, kde ilustruje objav fosforu. Zdroj: Joseph Wright of Derby [Public Domain] Fosfor bol izolovaný značkou Henning v roku 1669, keď bol prvým človekom, ktorý izoloval prvok. Značka bola nemecká alchymista z Hamburgu a podarilo sa jej získať zlúčeninu fosforu z moču. Aby to urobil, zhromaždil moč 50 vedier a dovolil mu rozložiť sa.
Značka potom odpala moč a získala načervený zvyšok, ktorý si zachoval niekoľko mesiacov. K tomu pridal piesok a zahrial sa, podarilo sa mu odstrániť plyny a oleje. Nakoniec získal bielu pevnú látku, ktorá žiarila v tme so zelenou farbou, ktorú nazval „studený oheň“.
Termín „fosfor“, náhodou pochádza z gréckeho slova „fosfor“, čo znamená nositeľ svetla.
Brand nezverejnila svoje experimentálne výsledky a predala ich niekoľkým alchymistom vrátane: Johann Kraft, Kunckel Lowenstern a Wilhelm Leibniz. Pravdepodobne niektorí z nich oznámili prácu značky na akadémii vied v Paríži, čím šírili svoje vyšetrovania.
Značka však v skutočnosti neizolovala fosfor, ale amoniakálny fosforečnan sodný [NH (NH (NH4) Po4]. V roku 1680 Robert Boyle zlepšil postup značky, prostredníctvom ktorého by mohol získať alotropnú formu fosforu (P4).
V kosti
Johan Gottlieb Gahn a Carl Wihelm Scheele v roku 1769 založili, že v kosti je fosfor zlúčenina, fosforečnan vápenatý. Nešťastné kosti boli podrobené procesu trávenia so silnými kyselinami, ako je kyselina sírová.
Potom sa produkt trávenia zahrieval v oceľových nádobách s uhlím a uhlím, čím sa získal biely fosfor destiláciou v retorte. Kosti boli hlavným zdrojom, ktorý získal fosfor do roku 1840, keď ich na tento účel nahradil guano.
V guano
Guano je zmes vtákov vtákov a ich výrobky z rozkladu. V 19. storočí sa použil ako zdroj fosforu a hnojív.
- Priemyselný rozvoj
Fosfátové horniny sa používali v roku 1850 ako zdroj fosforu. Toto spolu s vynálezom elektrickej rúry na kalcináciu hornín od Jamesa Burgesa Readmana (1888) urobilo fosfatické skaly hlavnú surovinu výroby fosforu a hnojivá.
V roku 1819 boli zriadené továrne Cerrillas, ktoré začali priemyselný rozvoj fosforu.
Fyzikálne a chemické vlastnosti
Vzhľad
V závislosti od alotropnej formy môže byť bezfarebná, uzavretá biela, žltá, šarlátová, červená, fialová alebo čierna.
Atómová hmotnosť
30 973 u
Atómové číslo (z)
pätnásť
Bod topenia
Biely fosfor: 44,15 ° C
Červený fosfor: ~ 590 ° C
Bod varu
Biely fosfor: 280,5 ° C
Hustota (okolitá teplota)
Biela: 1 823 g/cm3
Červená: 2,2-2,34 g/cm3
Violet: 2,36 g/cm3
Čierna: 2,69 g/cm3
Fúzne teplo
Biely fosfor: 0,66 kJ/mol
Odparovanie
Biely fosfor: 51,9 kJ/mol
Molárna kalikára
Biely fosfor: 23,824 J/(mol.K)
Oxidačné stavy
-3, -2, -1, +1, +2, +3, +4 a +5
V závislosti od elektronegativity prvkov, s ktorými môže fosfor ukazovať oxidačný stav +3 alebo -3. Fosfor, na rozdiel od dusíka, má tendenciu reagovať výhodne s oxidačným stavom +5; Taký je prípad pentoxidu fosforu (P2Ani5 alebo p25+Ani52+).
Môže vám slúžiť: rozpustné materiályElektronegativita
2,19 v Paulingovej stupnici
Ionizačná energia
-Prvé: 1.101 kJ/mol
-Po druhé: 2.190,7 kJ/mol
-Tretie: 2.914 kj/mol
Tepelná vodivosť
Biely fosfor: 0,236 w/(m · k)
Čierny fosfor: 12,1 w/(m · k)
Ukazuje, ako čierny fosfor vedie takmer šesťkrát viac tepla ako biely fosfor.
Magnetický poriadok
Biele, červené, fialové a čierne zápasy sú diamagnetické.
Izotopy
Fosfor má 20 izotopov, ktoré sú hlavnými: 31P, jediný stabilný izotop s množstvom 100%; 32P, emitor β izotop- a s polovičným životom 14,28 dní; a 33P, izotop β -emitor- A s polovičným životom 25,3 dní.
Fosforescencia
Biely fosfor je fosforeskujúci a v tme emituje zelené svetlo.
Alotropné zmeny
Biely fosfor je nestabilný a zmení sa na teploty blízko 250 ° C do polymérneho tvaru známeho ako červený fosfor, ktorý sa môže meniť oranžový až fialový oranžový. Je to amorfná látka, ale môže sa stať kryštalickou; Nesie v tme alebo horí vo vzduchu.
Biely fosfor pri vysokých teplotách a tlakoch alebo v prítomnosti katalyzátorov sa transformuje do polymérnej formy inej ako červeného fosforu: čierny fosfor. Jedná sa o čiernu, inertnú kryštalickú látku, podobnú grafitu a ktorá má schopnosť vykonávať elektrinu.
Rozpustnosť
Biely fosfor čistý je nerozpustný vo vode, hoci môže byť solubilizovaný v sulfide uhlíka. Medzitým sú červené a čierne zápasy nerozpustné vo vode a sú menej prchavé ako biely fosfor.
Reaktivita
Fosfor spaľuje spontánne vo vzduchu za vzniku p2Ani5, A to môže zase reagovať s tromi molekulami vody za vzniku ortofosforečnej alebo kyseliny fosforečnej (H3Po4).
Pôsobením horúcej vody pochádza z fosfínu (pH3) a fosforu oxacidy.
Kyselina fosforečná pôsobí na fosfované horniny spôsobujúce dihydrogén alebo superfosfátový fosforečnan vápenatého [CA [CA2Po4)2].
Môžete reagovať s halogénmi a vytvoriť halogenidy PX3, predstavujúce x až f, cl, br alebo i; o Haluros s receptúrou PX5, Byť x, cl alebo br.
Fosfor tiež reaguje s kovmi a metaloidmi, aby spôsobil fosfididy, a sírou za vzniku niekoľkých sulfidov. Na druhej strane sa viaže na kyslík, aby vznikol estery. Rovnakým spôsobom sa kombinuje s uhlíkom a vytvára organické zlúčeniny fosforu.
Elektronická štruktúra a konfigurácia
- Odkazy a tetraedrálna jednotka
Atómy fosforu majú nasledujúcu elektronickú konfiguráciu:
[Ne] 3s2 3p3
Preto päť elektrónov z Valencie, ako je dusík a ďalšie prvky skupiny 15. Pretože je to nemetalický prvok, jeho atómy musia tvoriť kovalentné väzby, kým sa okteto de Valencia nedokončí. Dusík to dosahuje, keď je stanovený ako datomické molekuly n2, S trojitým odkazom, n≡n.
To isté platí pre fosfor: dva z jeho atómov P sú spojené s trojicou väzby za vzniku molekuly p2, P≡p; To znamená, že difosfor. Fosfor má však väčšiu atómovú hmotnosť ako dusík a jeho orbitály 3p, difúznejšie ako 2p dusíka, prekrývajú s menšou účinnosťou; Preto P2 Existuje iba v plynnom stave.
Namiesto toho pri teplote miestnosti atómy P uprednostňujú kovalentne iným spôsobom: v tetraedrálnej molekule p4:
 Molekulárne jednotky p4 v kryštáloch bieleho fosforu. Zdroj: Benjah-Bmm27 Via Wikipedia.
Molekulárne jednotky p4 v kryštáloch bieleho fosforu. Zdroj: Benjah-Bmm27 Via Wikipedia. Všimnite si, že na vynikajúcom obrázku majú všetky atómy p tri jednoduché odkazy namiesto trojitého odkazu. Teda fosfor v P4 Dokončite svoje okteto de Valencia. Avšak v P4 V odkazoch P-P je napätie, pretože ich uhly idú do voľného oka, že sú 109,5 °.
- Alotropy
Biely fosfor
Rovnaký obraz jednotiek p4 A jeho nestabilita vysvetľuje, prečo je biely fosfor najstabilnejší alotropický z tohto prvku.
Jednotky P4 Sú nariadené vo vesmíre na definovanie kryštálu BCC (fáza a) za normálnych podmienok. Keď teplota zostupuje na -77,95 ° C, sklo BCC sa transformuje na HCP (pravdepodobne), hustejší (β fáza). To znamená, jednotky P4 Sú nariadené v dvoch alternatívnych vrstvách, A a B, aby vytvorili sekvenciu ABAB ..
Červený fosfor
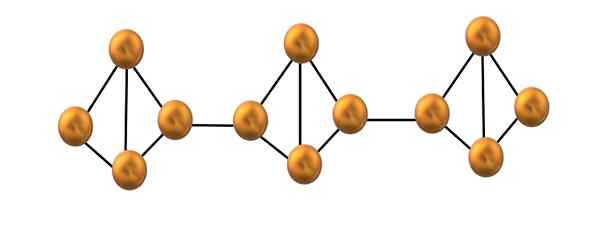 Štruktúra reťazca červeného fosforu. Zdroj: Gabriel Bolívar.
Štruktúra reťazca červeného fosforu. Zdroj: Gabriel Bolívar. Na hornom obrázku je zobrazený iba malý segment štruktúry červeného fosforu. Ako tri jednotky zarovnané „symetricky“, možno povedať, že ide o kryštalickú štruktúru, ktorá sa získa zahrievaním tohto fosforu nad 250 ° C.
Červený fosfor, väčšinou však pozostáva z pevného amorfného, takže jeho štruktúra je chaotická. Takže polymérne reťazce P4 Mali by bez zjavného vzoru, jeden vyššie a ďalšie pod rovnakým lietadlom.
Všimnite si, že toto je hlavný štrukturálny rozdiel medzi bielym a červeným fosforom: v prvom4 Sú individuálne a v druhých formujúcich reťazcoch. Je to možné, pretože jedno z odkazov P-P je rozbité vo vnútri Tetrahedronu, aby sa mohol prepojiť so susedným tetraedronom. Teda prstencové napätie a červený fosfor sú znížené väčšiu stabilitu.
Môže vám slúžiť: Zinok: História, vlastnosti, štruktúra, riziká, použitiaAk je zmes oboch alotropov, ponúka sa v dohľade ako žltý fosfor; Zmes tetrahedry a amorfných reťazcov fosforu. V skutočnosti biela fosfor.
Fialový alebo Hittorf fosfor
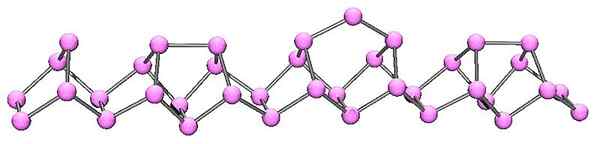 Molekulárna štruktúra fialového fosforu. Zdroj: kadmium v angličtine Wikipedia [verejná doména]
Molekulárna štruktúra fialového fosforu. Zdroj: kadmium v angličtine Wikipedia [verejná doména] Fialový fosfor je konečný vývoj červeného fosforu. Ako je možné vidieť na vynikajúcom obraze, naďalej pozostáva z polymérneho reťazca; Ale teraz sú štruktúry zložitejšie. Zdá sa, že štrukturálna jednotka už nie je p4 Ale P2, usporiadané takým spôsobom, že tvoria nepravidelné pentagonálne krúžky.
Napriek tomu, ako vyzerá asymetrická štruktúra, tieto polymérne reťazce sa dokážu dostatočne dobre a pravidelne, aby fialová fosfor.
Čierny fosfor
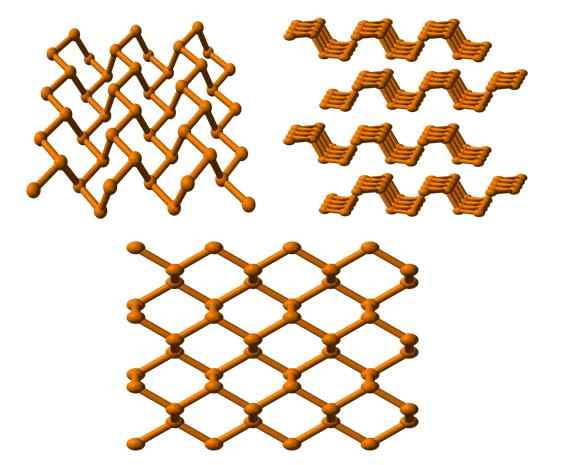 Štruktúra čierneho fosforu pozorovaná z niekoľkých uhlov. Zdroj: Benjah-Bmm27 [verejná doména].
Štruktúra čierneho fosforu pozorovaná z niekoľkých uhlov. Zdroj: Benjah-Bmm27 [verejná doména]. A nakoniec máme najstabilnejšiu fosforovú skupinu: čierna farba. Pripravuje biely fosfor pod tlakom 12.000 bankomat.
Na hornom obrázku (dole) je zrejmé, že jej štruktúra z vyššej roviny má určitú podobnosť so štruktúrou grafitu; Je to strmá sieť šesťuholníkových krúžkov (aj keď vyzerajú štvorcový).
V ľavom hornom rohu obrázka môžete lepšie oceniť novo komentované. Molekulárne prostredie atómov P sú trigonálna pyramída. Všimnite si, že bočné zobrazenie štruktúry (v pravom hornom rohu) je usporiadaný vo vrstvách, ktoré sa hodia na druhú.
Štruktúra čierneho fosforu je dosť symetrická a usporiadaná, čo súhlasí s jej schopnosťou etablovať sa ako orcombické kryštály. Stohovanie jeho polymérnych vrstiev spôsobuje atómy P, ktoré nie sú k dispozícii pre mnoho chemických reakcií; A preto je značne stabilný a malý reaktívny.
Aj keď to nie je potrebné spomenúť, londýnske disperzné sily a molárne masy týchto fosforečných tuhých látok sú tie, ktoré riadia niektoré z jej fyzikálnych vlastností; zatiaľ čo ich štruktúry a väzby P-P definujú chemické vlastnosti a iné.
Kde je to a získajte
Apatita a fosforit
Je to dvanásť prvkov Zeme kôrky a predstavuje 0,1% podľa hmotnosti. Existuje asi 550 minerálov, ktoré obsahujú fosfor, pričom apatita je najdôležitejším minerálom na získanie fosforu.
Apatita je minerál fosforu a vápnika, ktorý môže obsahovať variabilné množstvá fluoridu, chloridu a hydroxidu, ktorého vzorec je nasledujúci: [CA10(PO4)6(F, cl alebo OH)2)]. Okrem apatitu existujú aj ďalšie minerály fosforu, ktoré sú komerčné významné; Taký je prípad Wavelity a Vivianita.
Fosfátový alebo fosforitový hornina je hlavným zdrojom fosforu. Je to nestretková sedimentárna hornina, ktorá má obsah 15 až 20% fosforu. Fosfor je zvyčajne prítomný ako CA10(PO4)6F2 (Fluoroapatita). Je tiež prítomný ako hydroxyapatit, hoci v menšej miere.
Okrem toho sa fluórapatit nachádza súčasť vyvracia a metamorfných hornín, ako aj vápencov a bridlice.
Elektrotermálna redukcia fluórapatity
Vybrané fosfátové horniny sa prenášajú do čistiarne na spracovanie. Spočiatku sú rozdrvené, aby získali skalné fragmenty, ktoré sú potom mleté v guľôčkových mlynoch pri 70 revolúciách za minútu.
Potom je preosiatý produkt brúsenia skalných fragmentov, aby ich mohol zlomiť. Tieto frakcie sa vyberajú s 34% obsahom fosforu, ako je pentoxid fosforu (P2Ani5).
Biely fosfor (P4) Sa získava priemyselne elektrotermálnou redukciou fluórapatitu s uhlíkom pri teplote 1.500 ° C v prítomnosti oxidu kremíka:
2CA3(PO4)2(s) + 6sio2(s) + 10 c (s) => p4g) + Casio3(L) + co (g)
P4 V plynnom stave sa po kondenzácii zhromažďuje a skladuje ako biela pevná pevná látka ponorená do vody, aby sa zabránilo reagovaniu s vonkajším vzduchom.
Zliatiny
Medený
Pokrytie fosforu sa vyrába s rôznymi percentami medi a fosforu: Cu 94 % - p 6 %; CU 92% - P 8%; CU 85% - P 15%, atď. Zliatina sa používa ako deoxidant, hydratačný činiteľ pre priemysel medi a tiež ako nukleant v hliníkovom priemysle.
Broncín
Sú to zliatiny medi, fosforu a cín obsahujúce 0,5 - 11% fosfor a 0,01 - 0,35% TIn. Tin zvyšuje odolnosť proti korózii, zatiaľ čo fosfor.
Používa sa na vypracovanie prameňov, skrutiek a všeobecne v článkoch, ktoré si vyžadujú únavu, opotrebenie a chemickú koróziu. Odporúča sa jeho použitie v vrtule plavidiel.
Môže vám slúžiť: kadmium (CD): História, vlastnosti, štruktúra, použitieNictelladas
Najznámejšou zliatinou je štipkadvadsať, Použitie fosforovaného niklu v silných zváraných zliatinách, aby sa zlepšila jeho odolnosť voči chemickej erózii, oxidácii a vysokých teplotách.
Zliatina sa používa v komponentoch plynov a reakčných motorov, galvanoplastika a pri výrobe zváracích elektród.
Riziká
Biely fosfor vytvára vážne popáleniny pokožky a je to silný jed, ktorý môže byť smrteľný v dávke 50 mg. Fosfor inhibuje oxidáciu buniek, interferuje s bunkovým manažmentom kyslíka, čo môže viesť k degenerácii tuku a smrti bunky.
Otrava z akútnej fosforu spôsobuje v prvých štyroch dňoch bolesti brucha, horúčavy, dychu, vôňou cesnaku, fosforescenčným zvracaním, potu, svalových kŕčov a dokonca aj šokom stavu.
Následne sa prejavuje žltačka, petechiae, krvácanie, afektácia myokardu s arytmiami, zmenu centrálneho nervového systému a smrť v desiaty deň príjmu.
Najzreteľnejším prejavom otravy chronického fosforu je poškodenie kostnej štruktúry čeľuste.
Zvýšenie koncentrácie fosforu v plazme (Hyperfospatia) sa zvyčajne vyskytuje u pacientov so zlyhaním obličiek. To spôsobuje abnormálne ložisko fosfátov v mäkkých tkanivách, čo môže viesť k vaskulárnej dysfunkcii a kardiovaskulárnym ochorením.
Žiadosti
Fosfor je nevyhnutným prvkom pre rastliny a zvieratá. Je to jedna z troch hlavných živín rastlín, ktoré sú potrebné pre ich rastové a energetické požiadavky. Okrem toho je súčasťou nukleových kyselín, fosfolipidov, medziproduktov metabolických procesov atď.
U stavovcov je fosfor prítomný v kostiach a zuboch vo forme hydroxylapatitu.
- Elementárny fosfor
 Krabica zápasov alebo „fosfor“. Zdroj: pxhere.
Krabica zápasov alebo „fosfor“. Zdroj: pxhere. Pri fosforu sa vyrába chemická sklovina, ktorá sa používa na osvetlenie oznámení umiestnených na hliníku a jeho zliatinách; ako aj v medi a fosforovanom bronze.
Používa sa tiež na výrobu zápalných bômb, granátov, dymových čerpadiel a indikátorových guľiek. Červený fosfor sa používa pri vypracovaní bezpečnostných zápasov alebo zápasov.
Biely fosfor sa používa na vypracovanie organofosfátu. Okrem toho sa používa pri výrobe kyseliny fosforečnej.
Na výrobu tetraxidu fosforu sa spáli veľké množstvo fosforu (P4Ani10), získané ako prášok alebo tuhá látka.
- Zloženia
Fosfín
Je to surovina na vypracovanie niekoľkých zlúčenín fosforu. Pôsobí ako dopingové činidlo pre elektronické komponenty.
Kyselina fosforečná
Používa sa pri vypracovaní nealkoholických nápojov kvôli charakteristickej chuti, ktorá ich poskytuje. Pôsobiť na fosfátové horniny, aby sa vytvorila dihydrogénny fosfát vápenatého2Po4)2], známy tiež ako superfosfát, ktorý sa používa ako hnojivo.
Kyselina fosforečná je kondicionér prvkom zubnej skloviny na uľahčenie adhézie materiálov jeho obnovy. Používa sa tiež, zmiešaná s olejom, močovinou, zlomom, bitúmenom a pieskom, na vytvorenie asfaltu; Materiál použitý pri opravách kanálov komunikácie s pozemkami.
Organofosfor
Zlúčeniny organofosforu majú početné aplikácie; ako napríklad: spomaľovače horenia, pesticídy, extrakčné činidlá, činnosti nervov a úpravy vody.
Dihydrát dihydrátu vápenatého fosforečnanu
Používa sa ako hnojivo, prášok do pečiva, prídavná látka pre zvieratá a v rozpracovaní zubných pastov.
Fosfor pentoxid
Používa sa v chemickej analýze ako dehydratačné činidlo a v organickej syntéze ako kondenzátorové činidlo. Zlúčenina sa prideľuje hlavne na výrobu kyseliny ortofosforečnej.
Tripolyphosfát sodný
Používa sa v detergentoch a ako zmäkčovač vody, čo zlepšuje pôsobenie detergentov a pomáha vyhnúť sa korózii potrubí.
Trizodický fosfát
Používa sa ako čistiaci prostriedok a zmäkčovač vody.
Fosforečnany sodný
Dibasický fosfát sodný (NA2HPO4) a monobazický fosfát sodný (NAH2Po4) sú komponentmi systému tlmiča pH, ktorý dokonca pôsobí v živých bytostiach; Medzi nimi ľudské bytosti.
Odkazy
- Reid Danielle. (2019). Allotropy fosforu: formy, použitia a príklad. Štúdium. Získané z: štúdie.com
- Profesor. Robert J. Lancashire. (2014). Prednáška 5c. Štruktúra prvkov, pokračujte P, S a I. Získané z: Chem.Uwimona.Edu.Jm
- Byju's. (2019). Fosfor červený. Získané z: Byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang a kol. (2019). Elektronické štrukturálne a optické vlastnosti viacvrstvového modrého fosforu: štúdia prvého princípu. Journal of Nanomaterials, zv. 2019, ID článku 4020762, 8 strán. doi.org/10.1155/2019/4020762
- DR. Stewar. (2019). Fakty prvkov fosforu. Chemickolák. Získané z: Chemicool.com
- Wikipedia. (2019). Fosfor. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (3. júla 2019). Fakty fosforu (atómové číslo 15 alebo symbol prvkov P). Zotavené z: Thoughtco.com
- Linus Pauling Institute. (2019). Fosfor. Získané z: LPI.Oregonstate.Edu
- Bernardo Fajardo P. & Héctor Lozano V. (s.F.). Národné spracovanie fosforečnej horniny pre produkciu superfosfátu. [PDF]. Získané z: BDIGITAL.i.Edu.co
- Redaktori Enyclopaedia Britannica. (16. novembra 2018). Chemický prvok fosforu. Encyclopædia Britannica. Získané z: Britannica.com
- Reade International Corp. (2018). Zliatina medi fosfor (pohár). Obnovené z: Reade.com
- KBM Affilips. (27. decembra 2018). Master zliatina niklu fosfor (NIP). Azóm. Získané z: Azom.com
- Šošovica B.Vložka. (2019). Tabuľka obdobia: fosfor. Získané z: Lentech.com
- Abhijit naik. (21. februára 2018). Používať fosfor. Obnovené z: ScienceStruck.com
- « Vysvetlenie manometrického tlaku, vzorce, rovnice, príklady
- Trincheras Culture Pôvod, charakteristiky, náboženstvo, kultúra »

