Minimálny vzorec Ako odstrániť minimálny vzorec, príklady a cvičenia
- 2346
- 536
- Tomáš Klapka
Ten Minimálny alebo empirický vzorec Je to expresia pomeru, v ktorom sú prítomné atómy rôznych prvkov, ktoré tvoria chemickú zlúčeninu. Minimálny vzorec je preto najjednoduchším znázornením chemickej zlúčeniny. Na to je spôsobené „minimálnym“.
Minimálny vzorec nevyjadruje čísla atómov rôznych prvkov, ktoré tvoria chemickú zlúčeninu; ale podiel, v ktorom sú tieto atómy kombinované, aby sa vytvorila chemická zlúčenina.
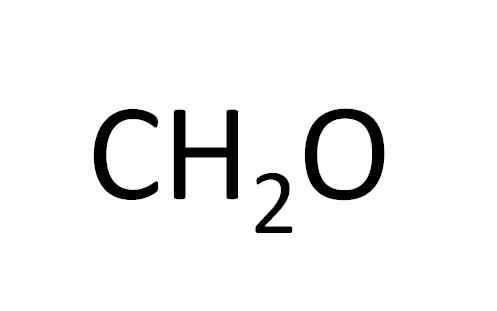
 Tento minimálny vzorec sotva odhalí, že zlúčenina má rovnaké množstvo atómov uhlíka a kyslíka a dvojité atómy vodíka. Zdroj: Gabriel Bolívar.
Tento minimálny vzorec sotva odhalí, že zlúčenina má rovnaké množstvo atómov uhlíka a kyslíka a dvojité atómy vodíka. Zdroj: Gabriel Bolívar. Minimálny vzorec sa tiež nazýva empirický vzorec, pretože sa získa z experimentovania; to znamená, že to súvisí so skúsenosťami. Experimentálne pozorovanie umožnilo k záveru, že dva atómy vodíka sa kombinujú s atómom vodíka za vzniku vody (H2Buď).
V mnohých prípadoch sa minimálny vzorec zhoduje s molekulárnym vzorcom. V molekulárnej časti sa objavujú reálne čísla rôznych prvkov, ktoré tvoria chemickú zlúčeninu; Ta je napríklad kyselina sírová (H2SW4).
Ale v iných prípadoch neexistuje náhoda z minimálneho vzorca a molekulárneho vzorca; To je prípad benzénu: minimálny vzorec je CH, zatiaľ čo jeho molekulárny vzorec je C6H6.
[TOC]
Ako získať minimálny vzorec?
Prvý krok
Nájdite gramy každého prvku prítomného v zlúčenine. Ako sa zvyčajne vyjadruje ako percento hmotnosti zlúčeniny, musí sa urobiť jednoduchý výpočet na transformáciu percentuálnych podielov hmotnosti hmotnosti prvkov.
Druhý krok
Získa sa relatívny počet atómov rôznych prvkov, ktoré tvoria chemickú zlúčeninu. Za týmto účelom je hmotnosť každého prvku rozdelená, vyjadrená v gramoch medzi jeho atómovou hmotnosťou.
Niektorí autori dávajú prednosť tomu, aby nazývali relatívny počet atómov, ako napríklad počet mólov atómov prvkov, ktoré sú súčasťou chemickej zlúčeniny.
Môže vám slúžiť: bután: Štruktúra, vlastnosti, použitia a rizikáTretí krok
Získanie minimálneho podielu vyjadreného v celom počte, každého z atómov prítomných v chemickej zlúčenine.
Na nájdenie týchto hodnôt sa relatívne čísla každého atómu prítomného v zlúčenine medzi relatívnou numerickou hodnotou, že atóm v chemickej zlúčenine je rozdelený.
V prípade, že hodnota minimálneho podielu atómu nie je celé číslo bez desatinných miest, musia sa vynásobiť všetky hodnoty minimálneho pomeru podľa čísla; Týmto spôsobom umožňuje, aby všetky hodnoty minimálneho pomeru boli celé čísla.
Napríklad, ak je hodnota minimálneho podielu atómu chemickej zlúčeniny 2.5, musí sa znásobiť všetko Hodnoty minimálneho podielu každého z atómov prítomných 2. Takže všetky hodnoty minimálneho podielu budú iba celé čísla.
Štvrtý krok
Napíšte minimálny zložený vzorec. Hodnoty minimálneho pomeru atómov rôznych prvkov sa umiestnia ako predplatné chemických symbolov prvkov na zapisovanie minimálneho vzorca.
Príklady minimálneho vzorca
Oxid vody a uhličitý
Väčšina chemických zlúčenín má vzorce, ktoré sú súčasne minimálne a molekulárne vzorce. Teda voda (h (h2O) je minimálny vzorec; Ale je to tiež molekulárny vzorec. To isté platí pre vzorec oxidu uhličitého (CO2).
Základné a kyslé oxidy
Základné oxidy a kyseliny sú chemické zlúčeniny, ktoré majú chemické vzorce, pokiaľ okrem výnimiek, ktoré sú minimálne aj molekulárne vzorce. Rovnaká situácia sa vyskytuje pri hydroxidoch a kyselinách, s výnimkou niektorých karboxylových kyselín.
Môže vám slúžiť: acetonitril (C2H3N)Octová kyselina
Karboxylové kyseliny, ktoré majú v ich zložení množstvo atómov uhlíka, sú samostatne, minimálny vzorec a molekulárny vzorec. Napríklad kyselina octová má molekulárny vzorec (C2H4Ani2); Ale tiež predstavuje minimálny vzorec (Cho2Buď).
Kyselina
Kyselina tiež má molekulárny vzorec (C4H8Ani2) a minimálny vzorec (c2H4Buď).
Etylénglykol
Ostatné organické zlúčeniny majú dva typy chemických vzorcov; To je prípad etylénglykolu, ktorý má molekulárny vzorec (C2H6Ani2) a minimálny vzorec (CHO3Buď).
Benzén
Benzén, aromatická zlúčenina, má molekulárny vzorec (C6H6) a minimálny vzorec (CH).
Glukóza
Glukóza má molekulárny vzorec (C6H12Ani6) a minimálny vzorec (CHO2Buď).
Vyriešené cvičenia
- Cvičenie 1
Etylénglykol je zlúčenina používaná ako nemrznúca zmes, má molekulovú hmotnosť 62,1 g/mol a ďalšie percentuálne zloženie hmotnosti:
C: 38 %,
H: 9,7 %
O: 51,16 %.
Prvý krok
Vyjadrite hmotnostné percento prvkov v ich masách v gramoch. Za týmto účelom sa molekulová hmotnosť etylenglicolu považuje za referenciu. Ak je to 62,1 gramov na mol, 38% z toho pozostáva z uhlíka. A tak ďalej s ostatnými prvkami:
Uhlíková hmotnosť = 62,1 g · (38/100)
= 23,6 g
Hmotnosť vodíka = 62,1 g · (9,7/100)
= 6 024 g
Hmotnosť kyslíka = 62,1 g · (51,16/100)
= 31,77 g
Druhý krok
Vypočítajte relatívny počet každého súčasného atómu (NRA) alebo počet mólov každého atómu. Za týmto účelom je hmotnosť každého chemického prvku vydelená jeho atómovou hmotnosťou.
NRA (C) = 23,6 g / 12 g
= 1,97
Môže byť zaokrúhlený na 2.
NRA (H) = 6 024 g / 1 g
= 6 024
Môže byť zaokrúhlený o 6.
NRA (O) = 31,77 g /16 g
= 1 985
Môže byť zaokrúhlený na 2.
Tretí krok
Vypočítajte minimálny podiel celého počtu prvkov zlúčeniny (PMNE). Za týmto účelom je každá z hodnôt atómových relatívnych čísel (NRA) vydelená najnižšou hodnotou tohto. V tomto prípade 2.
Môže vám slúžiť: kyselina propánPMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Štvrtý krok
Napíšte minimálny vzorec etylénglykol:
Chvály3Ani
Ako je vidieť, hodnoty získané v kroku 3 sú predplatné zložených prvkov.
- Cvičenie 2
Kyselina octová má molekulovú hmotnosť 60 g/mol a nasledujúce percento zloženia hmotnosti:
C: 40 %
H: 6,67 %
O: 53,33 %
Získajte minimálny zložený vzorec.
Prvý krok
Transformujte hmotnostné percentá prvkov na ich masy vyjadrené v gramoch:
Uhlíková hmotnosť = 60 g · (40/100)
= 24 g
Hmotnosť vodíka = 60 g · (6,67/100)
= 4 g
Hmotnosť kyslíka = 60 g · (53,33/100)
= 32 g
Druhý krok
Vypočítajte relatívne čísla atómov (NRA) zlúčeniny. Za týmto účelom sú masy prvkov rozdelené medzi ich atómové masy:
NRA (c) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (o) = 32 g / 16 g
= 2
Tretí krok
Získajte minimálny podiel celého počtu prvkov zlúčeniny (PMNE). Za týmto účelom sú hodnoty NRA prvkov rozdelené medzi nižšiu hodnotu NRA, ktorá predstavuje prvok:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Štvrtý krok
Napíšte minimálny vzorec kyseliny octovej:
Chvály2Ani
Predplatné zlúčeniny sú hodnoty získané z PMNE.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- HelMestine, Anne Marie, PH.D. (27. augusta 2019). Empirický vzorec: definícia a príklad. Zotavené z: Thoughtco.com
- Wikipedia. (2020). Empirický vzorec. Zdroj: In.Wikipedia.orgán
- Chémia librettexts. (3. júla 2019). Empirické výpočtové vzorce pre zlúčeniny. Získané z: Chem.Librettexts.orgán
- Nicola McDougal. (2020). Empirický vzorec: Definícia, kroky a príklad. Štúdium. Získané z: štúdie.com
- « Nezvratné reakčné charakteristiky a príklady
- Molekulárny vzorec, ako ho dostať von, príklady a cvičenia »

