Štruktúra hliníka fosforečnanu (ALPO4), vlastnosti, získanie, použitie, použitie

- 801
- 196
- Blažej Hrmo
On Hliníkový fosfát Je to anorganická tuhá látka tvorená hliníkovým iónom na3+ a fosfátový ión Po43-. Jeho chemický vzorec je Alpo4. Je to biela tuhá látka, ktorej kryštalická štruktúra je podobná ako v prípade silika sio2. Je nerozpustný vo vode.
Dá sa získať od hlinitého (na2Ani3) a kyselina fosforečná (h3Po4). Môže sa tiež získať na základe roztokov chloridu z vodného hliníka (ALCL3) a fosforečnan sodný (NA3Po4).
 Hliníkový fosfát4. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons.
Hliníkový fosfát4. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons. Hliníkový fosfát má veľmi vysoký bod fúzie, takže sa široko používa ako súčasť refraktérnej keramiky, tj keramika, ktorá vydrží veľmi vysoké teploty.
Používa sa tiež ako antacid na žalúdok, v zmesiach na opravu zubov a ako adjuvans vakcín, to znamená stimulovať imunitnú reakciu organizmu.
Niektorí refraktérny betón majú alpa4 Vo svojom zložení, ktoré zvyšuje mechanické a podporné vlastnosti vysokých teplôt tohto typu cementu.
Používa sa ako ochranný štít na zabránenie horľavých materiálov ako určitých polymérov.
[TOC]
Štruktúra
Alpo4 Tvorí sa hliníkovým katiónom na3+ a anión fosfátov po43-.
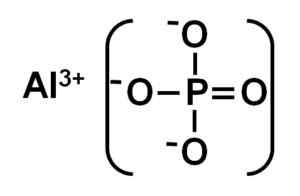 Iónová štruktúra hliníkového fosfátu. Autor: Marilú Stea.
Iónová štruktúra hliníkového fosfátu. Autor: Marilú Stea. Kryštalický hliníkový fosfát sa tiež nazýva berlinitová alebo alfa fáza (a-alpo4) a jeho kryštály sú podobné kremeňa.
 Syntetické berlinitové kryštály (a-alpo4). Dmgualtieri [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Syntetické berlinitové kryštály (a-alpo4). Dmgualtieri [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Alfa fáza hliníkového fosfátu je pevná látka tvorená kovalentnou sieťou po tetrahedry4 a Alpo4 toto striedanie a sú zjednotené atómami kyslíka.
Táto štruktúra je izomorfná s oxidom kremičitým, to znamená, že má rovnakú formu ako SIO2.
Menovanie
- Hliníkový fosfát
- Hliníkový monofosfát
- Hliníková soľ kyseliny fosforečnice.
Vlastnosti
Fyzický stav
Kryštalická biela pevná látka.
Molekulová hmotnosť
121,93 g/mol
Bod topenia
1800 ° C
Hustota
2,56 g/cm3
Rozpustnosť
Nerozpustné vo vode
Ďalšie vlastnosti
Alpo štruktúra4 Je to veľmi podobné ako u sio oxidu kremičitého2, Takže zdieľa veľa fyzikálnych a chemických vlastností.
Môže vám slúžiť: disionizovaná vodaHliníkový fosfát je vysoko refraktérny materiál, to znamená, že odoláva veľmi vysokým teplotám bez toho, aby zmenil jeho fyzickú podmienku alebo jeho štruktúru a bez rozkladu.
Alpo4 Kryštalický alebo berlinit, keď sa zahrieva, stáva sa štruktúrou typu Thunmimite a potom typu Christobalite, iné formy tejto zlúčeniny, ktoré sa podobajú na kremičitý Silio2.
 Hliníkový fosfát. Chemický úrok [verejná doména]. Zdroj: Wikimedia Commons.
Hliníkový fosfát. Chemický úrok [verejná doména]. Zdroj: Wikimedia Commons. Získanie
Hliníkový fosfát4 Sa dá získať reakciou medzi kyselinou fosforečnej h3Po4 a hlinitého al2Ani3. Vyžaduje sa aplikácia teploty, napríklad medzi 100 a 150 ° C.
Do2Ani3 + 2 h3Po4 = 2 Alpo4 + 3 h2Ani
Môže sa tiež získať spojením vodného roztoku hliníkového chloridu ALCL3 s vodným roztokom fosforečnanu sodného na3Po4:
Alcl3 + Nat3Po4 = Alpo4 + 3 NaCl
Používanie v keramike
Hliníkový fosfát4 Často sa vyskytuje v ústave keramiky z hlinitého.
Keramika s vysokým obsahom hlinitého je jedným z materiálov, ktoré sa používajú v aplikáciách, v ktorých je potrebné odolať vysokému zaťaženiu a závažným podmienkam.
Tento typ keramiky je odolný voči korózii, voči vysokoteplotným prostredím, k prítomnosti horúcej pary alebo v redukcii atmosféry, ako je oxid uhoľnatý (CO).
Keramika z hliníka má tiež nízku elektrickú a tepelnú vodivosť, takže sa používa na výrobu žiaruvzdorných tehál a izolačné komponenty elektriny.
 Refraktérny tehlový povlak, ktorý môže obsahovať alpoo hliníkový fosfát4. Tieto tehly chránia pred vysokými teplotami. Alexknight12 [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Refraktérny tehlový povlak, ktorý môže obsahovať alpoo hliníkový fosfát4. Tieto tehly chránia pred vysokými teplotami. Alexknight12 [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Pretože hliníkový fosfát sa tvorí pri oveľa nižšej teplote ako oxid kremičitý SIO2, Jeho výroba je lacnejšia, čo predstavuje výhodu pri výrobe keramiky vhodnej pre náročné služby.
Hliníkový fosfát keramika
Hliník je zvyknutý2Ani3 a kyselina fosforečná h3Po4 Vo vodnom médiu.
Preferované formovacie pH je 2-8, pretože existuje množstvo rozpustených druhov kyseliny fosforečnej, ako napríklad H2Po4- a HPO42-. Kyslá koncentrácia iónov pri3+ Je vysoký, od rozpustenia hlinitého po2Ani3.
Môže vám slúžiť: uhlíkový tetrachlorid (CCL4)V prvom rade hliníkový difhardrogénový trihydrogénový gél hliníka hydratovaného alh3(PO4)2.H2Buď:
Do3+ + H2Po4- + HPO42- + H2Alebo ⇔ alh3(PO4)3.H2Ani
Prichádza však čas, keď pH nízkeho roztoku a stáva sa neutrálnym, kde hliník do2Ani3 predstavuje nízku rozpustnosť. V tejto dobe nerozpustný hliník tvorí vrstvu na povrchu častíc, ktoré bránia reakcii pokračovať.
Preto je potrebné zvýšiť rozpustnosť hlinitého, čo sa dosiahne hladko. Zahrievaním pri 150 ° C gél pokračuje v reakcii s hlinitou na2Ani3 uvoľnenie vody a tvorí kryštalickú Berlinita (alfa-alpo4).
Do2Ani3 + 2 Alh3(PO4)3.H2O → Alpo4 + 4 h2Ani
Berlinita sa spája s jednotlivými časticami a keramiky.
Iné použitia
Alpo4 Používa sa ako antacid, ako adsorbent, ako molekulárne sito, ako je napríklad podpora katalyzátora a povlak na zlepšenie rezistencie na koróziu horúcej korózie. Tu sú ďalšie aplikácie.
Pri získavaní betónu
Hliníkový fosfát je zložka žiaruvzdorného alebo betónu rezistentného tepla.
Poskytuje vynikajúce mechanické vlastnosti a refraktingové látky pre tento betón, napríklad tepelný odpor. V teplotnom intervale medzi 1400-1600 ° C je bunkový betón na základe fosfátu hliníka jedným z najúčinnejších materiálov, ako je tepelný izolátor.
Nevyžaduje sa sušenie, jeho kalenie sa dosiahne exotermickou reakciou, ktorá sa sama osebela. Je možné pripraviť tehly tohto materiálu v akejkoľvek forme a veľkosti.
V zubných cementoch
Hliníkový fosfát je súčasťou zubných alebo materiálových cementov, ktoré sa používajú na vyliečenie chrápanej protézy.
V zubných cementoch sa hliník používa ako moderátor reakcií na báze kyseliny, kde moderujúci účinok je spôsobený tvorbou fosfátu hlinitého na časticiach iných materiálov.
Tieto cementy majú veľmi vysokú odolnosť v oblasti kompresie a napätia, čo je spôsobené prítomnosťou hliníkového fosfátu.
 Zubné cementy používané na vyliečenie zubného kazu môžu obsahovať hliníkový fosfát. Autor: Gerberova výzva. Zdroj: Pixabay.
Zubné cementy používané na vyliečenie zubného kazu môžu obsahovať hliníkový fosfát. Autor: Gerberova výzva. Zdroj: Pixabay. Vo vakcínach
Alpo4 Používa sa už mnoho rokov v niekoľkých ľudských vakcínach na zlepšenie imunitnej reakcie tela. Hovorí sa, že Alpo4 Je to „adjuvant“ vakcín. Mechanizmus ešte nie je pochopený.
Môže vám slúžiť: chlorid lítium (LICL): vlastnosti, riziká a použitiaJe známe, že Alpoov imunostimulačný účinok4 Závisí to od adsorpčného procesu antigénu od adjuvansu, to znamená spôsob, akým sa k tomu dodržiava. Antigén je zlúčenina, ktorá pri vstupe do tela vytvára tvorbu protilátok na boj proti špecifickej chorobe.
Antigény môžu byť adsorbované do alpa4 elektrostatickými interakciami alebo väzbou s ligandami. Adsorb na povrchu adjuvans.
Tiež sa verí, že veľkosť alpo častíc4 Má tiež vplyv. Nižšia veľkosť častíc, odozva protilátky je väčšia a odolnejšia.
 Vakcíny môžu obsahovať alpoo hliníkový fosfát4 Zvýšiť jeho účinnosť. Autor: Tumisu. Zdroj: Pixabay.
Vakcíny môžu obsahovať alpoo hliníkový fosfát4 Zvýšiť jeho účinnosť. Autor: Tumisu. Zdroj: Pixabay. Ako spomaľovač horenia polyméru
Alpo4 Používa sa ako zapaľovanie a vyhýba sa spaľovaniu alebo spáleným z určitých polymérov.
Pridanie alpa4 do polypropylénového polyméru, ktorý už má spomalenie horenia, spôsobuje synergický účinok medzi oboma retardérmi, čo znamená, že účinok je oveľa väčší ako účinok oboch zapaľovaných samostatným.
Keď je polymér vystavený spaľovaniu alebo spáleným v prítomnosti alpa4, Vytvára sa hliníkový metafosfát, ktorý preniká do karbonizovaného povrchu a napĺňa póry a praskliny z toho.
To vedie k tvorbe vysoko účinného ochranného štítu, aby sa zabránilo spaľovaniu alebo spaľovaniu polyméru. Inými slovami Alpo4 utesnite karbonizovaný povrch a zabraňuje spaľovaniu polyméru.
 S Alpo4 Spaľovanie určitých polymérov je možné oneskoriť. Autor: Hans Braxmeier. Zdroj: Pixabay.
S Alpo4 Spaľovanie určitých polymérov je možné oneskoriť. Autor: Hans Braxmeier. Zdroj: Pixabay. Odkazy
- Abyzov, V.Do. (2016). Ľahký refraktérny betón založený na spojive hliníka-magnéium-fosforečnan. Engineering 150 (2016) 1440-1445. Zotavené z vedeckých pracovníkov.com.
- Wagh, a.Siež. (2016). Keramika hliníkového fosfátu. V chemicky viazanej fosfátovej keramike (druhé vydanie). Kapitola 11. Zotavené z vedeckých pracovníkov.com.
- Mei, C. a kol. (2019). Vakcína proti fosforečnanu hliníka Atjuvant: Analýza zloženia a veľkosti používanie off-line a in-line nástrojov. Comput Struct Biotechnol J. 2019; 17: 1184-1194. NCBI sa zotavila.NLM.NIH.Vláda.
- Qin, Z. a kol. (2019). Synergický bariérový účinok hliníka fosfátu na polypropylén spomalený horením založený na systéme polyfosfátu amónneho. Materiály a dizajn 181 (2019) 107913. Zotavené z vedeckých pracovníkov.com.
- Vrieling, h. a kol. (2019). Stabilizované nanaplátky fosfátu hliníka používané ako vakcína atjuvanta. Koloidy a povrchy B: Biointerfaces 181 (2019) 648-656. Zotavené z vedeckých pracovníkov.com.
- Schaefer, C. (2007). Gastrointestinálne lieky. Antacidy. V drogách počas tehotenstva a laktácie (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Rouquerol, f. a kol. (1999). Vlastnosti nových adsorbentov. Pri adsorpcii pomocou výkonov a poréznych tuhých látok. Zotavené z vedeckých pracovníkov.com.
- « Notácie vyvinuli, čo je, príklady a cvičenia
- Afro -colombia pôvod, história, charakteristiky, dôležitosť »

