Štruktúra lítium fluoridu, vlastnosti, získanie, použitie, použitia

- 2011
- 581
- Tomáš Klapka
On Lítium fluorid Je to anorganická tuhá látka, ktorej chemický vzorec je LIF. Je tvorený li iónmi+ a f- ktoré sú spojené prostredníctvom iónového zväzku. Nachádza sa v malých množstvách v niekoľkých mineráloch, najmä kremičitany, ako je lepidolit, morská voda a v mnohých minerálnych vrtoch.
Na optických zariadeniach sa široko využíva kvôli svojej priehľadnosti v širokej škále vlnových dĺžok, od infračerveného spektra (IR) po UV ultrafialové, cez viditeľné.
 Lepidolit, minerál, ktorý obsahuje malé množstvá fluoridu životného. Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Lepidolit, minerál, ktorý obsahuje malé množstvá fluoridu životného. Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Používa sa tiež na zariadenia. Okrem toho sa používa ako materiál na rozpustenie hliníka alebo na výrobu okuliarov alebo pohárov skla a výroby keramiky.
Slúži ako materiál na pokrytie zložiek lítium -ionových batérií a na zabránenie počiatočnej straty zaťaženia týchto.
[TOC]
Štruktúra
Fluorid lítium je iónová zlúčenina, ktorá je tvorená spojením Li katiónu+ a anión f-. Sila, ktorá ich udržuje pohromade, je elektrostatická a nazýva sa iónová väzba.
Keď sa líti kombinuje, dáva elektrón fluoridu, obidve sú stabilnejšie ako počiatočný spôsob, ako je vysvetlené nižšie.
Lítiový prvok má nasledujúcu elektronickú konfiguráciu: [He] 1s2 2s1 A keď dáva elektrón, elektronická štruktúra je taká: [on] 1s2 Čo je oveľa stabilnejšie.
Fluórový prvok, ktorého elektronická konfigurácia je: [NE] 1S2 2s2 2 P5, Prijatím elektrónu je forma [ne] 1S2 2s2 2 P6, stabilnejší.
Menovanie
- Lítium fluorid
- Fluóritio
Môže vám slúžiť: nemetalické oxidy- Monofluorid lítium
Vlastnosti
Fyzický stav
Biela tuhá látka, ktorá kryštalizuje v kubickej štruktúre, ako je napríklad chlorid sodný.
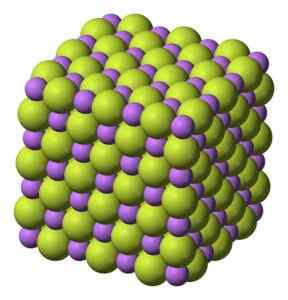 Kubická štruktúra kryštálov fluoridu LiF lítium. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Kubická štruktúra kryštálov fluoridu LiF lítium. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Molekulová hmotnosť
26 g/mol
Bod topenia
848,2 ° C
Bod varu
1673 ° C, hoci je prchavý pri 1100-1200 ° C
Hustota
2 640 g/cm3
Index lomu
1 3915
Rozpustnosť
Malé rozpustné vo vode: 0,27 g/100 g vody pri 18 ° C; 0,134 g/100 g pri 25 ° C. Rozpustný v kyslom médiu. Nerozpustný v alkoholu.
Ďalšie vlastnosti
Jeho výpary majú dimické druhy (LIF)2 a trimérne (LIF)3. S HF Fluorhororovou kyselinou tvorí lihf lítium2; S hydroxidom lítium tvorí soľ s dvojitým životom.Klima.
Získanie a umiestnenie
Fluorid lítium LIF sa môže získať reakciou medzi kyselinou fluorhorhorovou a lioh lítium hydroxidu alebo lítium -lítiu uhličitanu2Co3.
Je však prítomný v malých množstvách v určitých mineráloch, ako je lepidolit a morská voda.
 Fluorid lítia sa nachádza v malých množstvách v morskej vode. Adeeb Atwan [CC o 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons.
Fluorid lítia sa nachádza v malých množstvách v morskej vode. Adeeb Atwan [CC o 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons. Žiadosti
V optických aplikáciách
LIF sa používa vo forme kompaktných kryštálov v infračervených spektrofotometre (IR) v dôsledku vynikajúcej disperzie, ktorú majú v intervale vlnovej dĺžky medzi 4000 a 1600 cm-1.
Kryštály LIF LIF sa získavajú zo nasýtených roztokov z tejto soli. Môže nahradiť prírodné kryštály fluoritu v rôznych typoch optických zariadení.
Veľké a čisté kryštály sa používajú v optických systémoch pre ultrafialové svetlo (UV), viditeľné a IR a röntgenové monochromátory (0,03-0,38 nm).
 Life Life Fluoruro Crystal, vo vnútri kadičky. V1adis1av [verejná doména]. Zdroj: Wikimedia Commons.
Life Life Fluoruro Crystal, vo vnútri kadičky. V1adis1av [verejná doména]. Zdroj: Wikimedia Commons. Používa sa tiež ako optický materiál na povlaky pre UV región kvôli svojmu širokému optickému pásmu, väčšie ako v prípade iných kovových fluoridov.
Môže vám slúžiť: zásadné kovyVďaka jeho priehľadnosti vo vzdialenej UV (90-200 nm) je ideálny ako ochranný povlak v hliníkových zrkadlách (AL). Zrkadlá LIF/AL sa používajú v optických systémoch teleskopu pre vesmírne aplikácie.
Tieto povlaky sa dosahujú fyzickým ukladaním depozície pary a vrstiev na atómovej úrovni.
V ionizujúcich alebo nebezpečných detektoroch žiarenia
Fluorid lítia sa široko používa v termoluminiscenčných detektoroch pre fotóny, neutrónové a p (beta) žiarenie.
Termoluminiscenčné detektory udržiavajú energiu žiarenia, keď je to vystavené. Následne pri ich zahrievaní uvoľňuje energiu uloženú v svetlej forme.
Pre túto aplikáciu je LIF všeobecne datovaný s nečistotami horečnatého (MG) a titánom (TI). Tieto nečistoty generujú určité hladiny energie, ktoré pôsobia ako diery, kde sú elektróny uvoľňované žiarením zachytené. Keď sa materiál potom zahrieva, tieto elektróny sa vrátia do pôvodného energetického stavu emitingu svetla.
Intenzita emitovaného svetla závisí priamo od energie absorbovanej materiálom.
Termoluminiscenčné detektory LIF boli úspešne testované na meranie komplexných polí žiarenia, ako sú tie, ktoré sú prítomné vo veľkom Hadron Collider alebo LHC (pre jeho skratku pre angličtinu Veľký hadrón), ktorá sa nachádza v Európskej organizácii pre jadrový výskum, známa ako CERN (pre svoju skratku francúzštiny Conseil Européen naleje recherche jadrovú nukleire).
Žiarenie v skúsenostiach uskutočňovaných v tomto výskumnom centre sú prítomné Hadrones, neutróny a elektróny/pozitróny, okrem iných typov subatomických častíc, z ktorých všetky sa dajú zistiť pomocou LIF.
Ako materiál na predbežnú katódu lítiovej batérie
LIF bol úspešne testovaný vo forme nanokompozitov s kobaltom (CO) a železom (viery) Predbežnosť) materiálu katódového materiálu na lítium -ion.
Môže vám slúžiť: etyléterPočas prvého cyklu zaťaženia alebo fázy tvorby lítium -iónovej batérie sa organický elektrolyt rozkladá, aby sa vytvoril pevná fáza na povrchu anódy.
Tento proces spotrebuje lítia katódy a znižuje energiu medzi 5 až 20% z celkovej kapacity lítium -iónovej batérie.
Z tohto dôvodu sa skúmala elektrochemická predbežná predbežná predpredaj katódy, ktorá generuje elektrochemickú extrakciu lítia nanokomponovaného, ktorý pôsobí ako darca lítia, čím sa zabráni konzumácii lítia katód.
Nanokompozity LIF/CO a LIF/FE majú vysokú kapacitu na darovanie lítia katóde, pričom sa dá ľahko syntetizovať, stabilne v podmienkach spracovania životného prostredia a batérie.
 Lítium -iónová batéria. Autor: MR.ちゅら さん. Littium_battery * Fotografický deň, august 2005 * Fotografická osoba Aney. Zdroj: Wikimedia Commons.
Lítium -iónová batéria. Autor: MR.ちゅら さん. Littium_battery * Fotografický deň, august 2005 * Fotografická osoba Aney. Zdroj: Wikimedia Commons. Na niekoľkých použitiach
Fluorid lítium sa používa ako zvárací meter, najmä hliník a vo zváraných náteroch. Používa sa tiež v bunkách redukcie hliníka.
Všeobecne sa používa pri výrobe skla (ako napríklad šošoviek), v ktorých znižuje koeficient expanzie. Používa sa tiež vo výrobe keramiky. Okrem toho sa používa pri výrobe smaltových a sklovitých lakov.
LIF je zložkou paliva pre rakety a palivá pre určité typy reaktorov.
LIF sa tiež používa v diódach emitujúce svetlo alebo fotovoltaické komponenty na vstrekovanie elektrónov do vnútorných vrstiev.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Alebo.Siež. Lekárska knižnica. (2019). Fluorid. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Obryk, b. a kol. (2008). Reakcia rôznych typov detektorov fluoridov TL lítium na vysoko anergy zmiešané radiačné polia. Merania žiarenia 43 (2008) 1144-1148. Zotavené z vedeckých pracovníkov.com.
- Slnko. a kol. (2016). Pri situálnej chemickej syntéze nanokompozitu lítium fluorid/kov pre vysoko kapacitnú predbežnú predbežnú predpis katód. Nano Letters 2016, 16, 2, 1497-1501. Získané z krčiem.ACS.orgán.
- Hennessy, J. a Nikzad, s. (2018). Depozícia atómovej vrstvy optických povlakov lítium fluoridu pre ultrafialové. Inorganics 2018, 6, 46. MDPI sa zotavila.com.
- « 10 Vedecké experimenty pre fyzikálne sekundárne, chémiu, biológia
- Štruktúra kyseliny metylmalónovej, vlastnosti, syntéza, používa »

