História, popis a závery Rutherford experimenty
- 5192
- 633
- JUDr. Rudolf Čapkovič
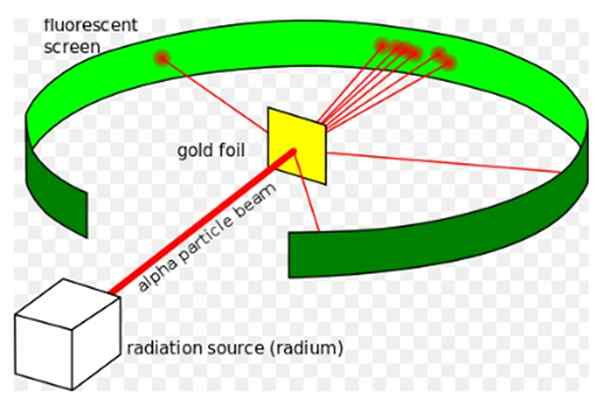
On Experiment Rutherford, Vykonané v rokoch 1908 až 1913, pozostával z bombardovania tenkého zlatého plechu 0.0004 mm hrubý, s alfa časticami a analyzujte disperzný vzor, ktorý tieto častice ponechali na fluorescenčnej obrazovke.
V skutočnosti Rutherford uskutočnil početné experimenty a stále viac zdokonaľoval podrobnosti. Po starostlivej analýze výsledkov boli odhalené dva veľmi dôležité závery:
-Pozitívne zaťaženie atómu je koncentrované v oblasti nazývanej jadro.
-Toto atómové jadro je neuveriteľne malé v porovnaní s veľkosťou atómu.
 postava 1. Rutherfordov experiment. Zdroj: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
postava 1. Rutherfordov experiment. Zdroj: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Ernest Rutherford (1871-1937) bol fyzik narodený na Novom Zélande, ktorého záujmom bolo rádioaktivita a povaha hmoty. Rádioaktivita bola nedávnym fenoménom, keď Rutherford začal svoje experimenty, objavil ho Henri Becquerel v roku 1896.
V roku 1907 sa Rutherford presťahoval na University of Manchester v Anglicku, aby študoval štruktúru atómu, pričom tieto alfa častice s použitím sond na preskúmanie interiéru takej malej štruktúry. Fyzisti Hans Geiger a Ernest Marsden ho sprevádzali v úlohe.
Nachádzali nádej, že uvidia, ako sa alfa častica, ktorá je dvojitým ionizovaným atómom hélia, interagovaná s jedinečným atómom zlata, aby sa zabezpečilo, že akákoľvek odchýlka, ktorú zažila, bola spôsobená iba elektrickou silou.
Väčšina alfa častíc však prekročila zlatý plech, ktorý trpí iba malá odchýlka.
Táto skutočnosť bola v úplnom zhode s Thomsonovým atómovým modelom, s prekvapením vedcov, malé percento alfa častíc zaznamenalo celkom pozoruhodnú odchýlku.

A ešte menšie percento vrátených častíc, čím sa úplne poskakuje dozadu. Prečo boli tieto neočakávané výsledky?
[TOC]
Opis a závery experimentu
V skutočnosti sú alfa častice, ktoré Rutherford používal ako sonda, héliové jadrá a v tom čase bolo známe, že tieto častice mali pozitívny náboj. Dnes je známe, že alfa častice sa skladajú z dvoch protónov a dvoch neutrónov.
Rutherford identifikovali častice Alfa a beta ako dva rôzne druhy žiarenia od uránu. Alfa častice, oveľa masívnejšie ako elektrón, majú pozitívny elektrický náboj, zatiaľ čo beta častice môžu byť elektróny alebo pozitróny.
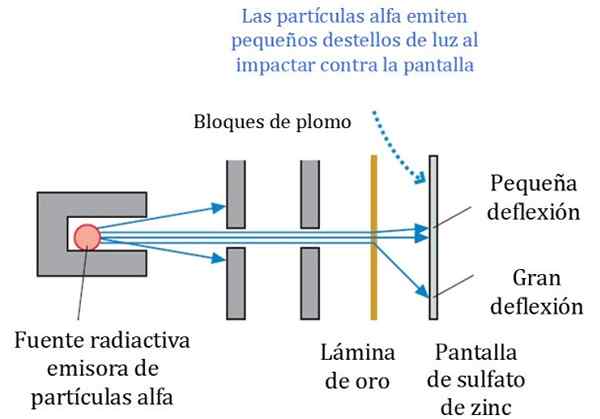 Obrázok 2. Podrobná schéma experimentu Rutherford, Geiger a Marsden. Zdroj: r. Rytier. Fyzika pre vedcov a inžinierstvo: Strategický prístup. Pearson.
Obrázok 2. Podrobná schéma experimentu Rutherford, Geiger a Marsden. Zdroj: r. Rytier. Fyzika pre vedcov a inžinierstvo: Strategický prístup. Pearson. Obrázok 2 zobrazuje zjednodušenú schému experimentu. Alfa časticový lúč pochádza z rádioaktívneho zdroja. Geiger a Marsden použili ako emitor plyn Radon.
Olovené bloky sa použili na nasmerovanie žiarenia na zlatý list a zabránili im zastavenie priamo na fluorescenčnú obrazovku. Olovo je materiál, ktorý absorbuje žiarenie.
Môže vám slúžiť: Centrioles: Funkcie a vlastnostiPotom bol teda riadený lúč ovplyvnený tenký zlatý list a väčšina častíc sleduje ich cestu k fluorescenčnej obrazovke síranu zinočnatého, kde zanechali malú ľahkú stopu. Geiger mal na starosti ich počítanie jeden po druhom, aj keď potom navrhli zariadenie, ktoré to urobilo.
Skutočnosť, že niektoré častice zažili malú deformáciu, neprekvapila Rutherforda, Geiger a Marsden. Koniec koncov, v atóme existujú pozitívne a negatívne náboje, ktoré vyvíjajú pevnosť na alfa častice, ale keďže atóm je neutrálny, čo už vedeli, odchýlky by mali byť malé.
Prekvapením experimentu je, že niekoľko pozitívnych častíc sa odrazilo takmer priamo.
Závery
Približne 1 z 8 000 alfa častíc zaznamenalo vychýlenie v uhloch väčších ako 90 °. Málo, ale dosť na to, aby som spochybnil niektoré veci.
Atomický model v Boga bol model Thomsonovho Pudina, bývalý profesor Rutherford v Laboratóriu Cavendish, ale premýšľal, či myšlienka atómu bez jadra a s elektrónmi vloženými ako hrozienka, bola správna.
Pretože sa ukázalo, že tieto veľké vychýlenie alfa častíc a skutočnosť, že niekoľko sú schopných vrátiť sa, dá sa vysvetliť iba vtedy, ak má atóm malé, ťažké a pozitívne jadro. Rutherford predpokladal, že za akúkoľvek odchýlku sú zodpovedné iba sily elektrickej príťažlivosti a odporu, ako naznačuje Coulombov zákon.
Keď sa niektoré z alfa častíc priamo blížia k jadru a keďže sa elektrická sila mení s reverzným štvorcom vzdialenosti, cítia odpor, ktorý im spôsobuje disperziu veľkého uhla alebo odchýlky dozadu.
Aby sa zabezpečilo, Geiger a Marsden zažili bombardovacie listy rôznych kovov, nielen zlato, hoci tento kov bol najvhodnejší pre ich poddajnosť, aby sa vytvorili veľmi jemné plachty.
Pri získavaní podobných výsledkov Rutherford presvedčil, že pozitívne zaťaženie atómu by sa malo nachádzať v jadre a nie je rozptýlené v celom jeho objeme, ako to Thomson vo svojom modeli predpokladal vo svojom modeli.
Na druhej strane, podobne ako veľká väčšina častíc alfa, sa to stalo bez toho, aby sa odchýlilo, jadro by malo byť veľmi, veľmi malé v porovnaní s atómovou veľkosťou. Toto jadro však muselo sústrediť väčšinu hmotnosti atómu.
Vplyvy v modeli atómu
Výsledky boli veľmi prekvapené Rutherfordom, ktorý vyhlásil na konferencii v Cambridge: "... je to ako keď zastrelíte 15 -inch delovú guľku proti plechu hodvábneho papiera a projektil sa odrazí priamo k vám a zasiahne vás„.
Môže vám slúžiť: 10 funkcií teoretického rámca vyšetrovaniaKeďže tieto výsledky nemohli byť vysvetlené Thomsonovým atómovým modelom, Rutherford navrhol, že atóm bol vytvorený jadrom, veľmi malým, veľmi masívnym a pozitívne naložený. Elektróny zostali opisujúce obežné dráhy okolo nich, ktoré solárny miniatúrny systém.
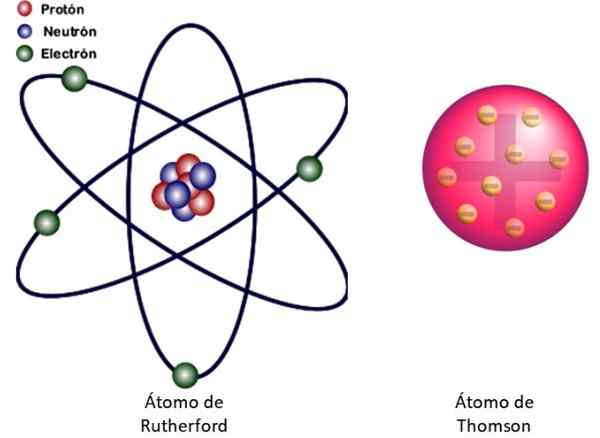 Obrázok 3. Vľavo atómový model Rutherfordu a vpravo model Buddinovho typu Thomsonovho. Zdroj: Wikimedia Commons. Ľavý obrázok: JCymc90 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Obrázok 3. Vľavo atómový model Rutherfordu a vpravo model Buddinovho typu Thomsonovho. Zdroj: Wikimedia Commons. Ľavý obrázok: JCymc90 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Toto je jadrový model atómu znázornený na obrázku 3 vľavo. Pretože elektróny sú veľmi, veľmi malé, ukázalo sa, že atóm je takmer všetko .. . vyprázdniť! Preto väčšina alfa častíc prechádza cez plachtu bez toho, aby sa odchýlila.
A analógia s miniatúrnou slnečnou sústava je veľmi úspešná. Atómové jadro hrá úlohu slnka, ktoré obsahuje takmer celú hmotnosť plus pozitívne zaťaženie. Elektróny obežná dráha okolo nich ako planéty a nosia záporné zaťaženie. Sada je elektricky neutrálna.
Pokiaľ ide o distribúciu elektrónov v atóme, Rutherfordov experiment nevykazoval nič. Dalo by sa predpokladať, že alfa častice budú mať s nimi určitú interakciu, ale hmotnosť elektrónov je príliš malá a nedokázala výrazne odvrátiť častice.
Nevýhody v modeli Rutherford
Problémom s týmto atómovým modelom bolo presne správanie elektrónov.
Keby to nebolo statické, ale obiehajúce atómové jadro v kruhových alebo eliptických dráhach, riadené elektrickou príťažlivosťou, nakoniec by sa ponáhľali do jadra.
Je to preto, že zrýchlené elektróny strácajú energiu, a ak sa tak stane, bol by to kolaps atómu a hmoty.
Našťastie to nie je to, čo sa stane. Existuje určitá dynamická stabilita, ktorá sa vyhýba zrúteniu. Ďalším atómovým modelom, po Rutherfordovom, bol model Bohra, ktorý dal niekoľko odpovedí na to, prečo k atómovému kolapsu nedošlo.
Protón a neutrón
Rutherford pokračoval v experimentoch s disperziou. V rokoch 1917 až 1918 sa on a jeho asistent William Kay rozhodli bombardovať.
Pri detekcii vodíkových jadier to bolo opäť prekvapené. Toto je reakčná rovnica, prvá umelá jadrová transmutácia sa nikdy nedosiahla:
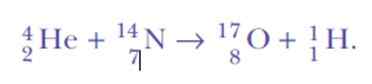 Ak sú alfa častice héliové jadrá, odkiaľ môžu vodíkové jadrá pochádzať?
Ak sú alfa častice héliové jadrá, odkiaľ môžu vodíkové jadrá pochádzať?
Odpoveď znie: z toho istého dusíka. Rutherford priradil atómové číslo 1 vodíka, pretože je najjednoduchším prvkom všetkých: pozitívne jadro a negatívny elektrón.
Rutherford našiel základnú častice, ktorú nazval protón, meno odvodené z gréckeho slova do najprv. Týmto spôsobom je protón nevyhnutnou zložkou každého atómového jadra.
Môže vám slúžiť: ZväzokNeskôr, do roku 1920, Rutherford navrhol, aby existovala neutrálna častica a s hmotnosťou veľmi podobnou hmotnosti protónu. Nazval túto častice neutrón a je súčasťou takmer všetkých známych atómov. Fyzik James Chadwick to konečne identifikoval v roku 1932.
Aký je mierka modelu atómu vodíka?
Atóm vodíka je, ako sme už povedali, najjednoduchší zo všetkých. Nebolo však ľahké rozpracovať model tohto atómu.
Postupné objavy vyvolali kvantovú fyziku a celú teóriu, ktorá popisuje javy atómovej úrovne. Počas tohto procesu sa vyvíjal aj atómový model. Pozrime sa však trochu na otázku veľkostí:
Atóm vodíka má jadro zložené z protónu (pozitívne) a má jeden elektrón (negatívny).
Polomer atómu vodíka bol odhadnutý na 2.1 x 10-10 m, zatiaľ čo protón je 0.85 x 10 -pätnásť m alebo 0.85 femtometre. Názov tejto malej jednotky je spôsobený enrico fermi a pri práci na tomto rozsahu sa používa veľa.
Dobre, kvocient medzi polomerom atómu a jadrom je rádovo 105 M, to znamená, že atóm je 100 000 -krát väčší ako jadro!.
Musíme však mať na pamäti, že v súčasnom modeli, založenom na kvantovej mechanike, elektrón zahŕňa jadro v akomkoľvek oblaku zvanom orbitálny (Orbitál nie je obežná dráha) a elektrón v atómovej mierke nie je presný.
Ak je atóm vodíka široko rozšírený - do veľkosti futbalového ihriska, potom by jadro zložené z pozitívneho protónu by bolo veľkosť mravca v strede poľa, zatiaľ čo negatívny elektrón by bol ako druh ducha, rozptýlené po celom poli a obklopujúce pozitívne jadro.
Atómový model dnes
Tento „planétový“ atómový model je veľmi zakorenený a je obrazom, ktorý má väčšina ľudí z atómu, pretože je veľmi ľahké vizualizovať sa. Však, Nie je to Model prijatý dnes vo vedeckej oblasti.
Súčasné atómové modely sú založené na kvantovej mechanike. Poukazuje na to, že elektrón v atóme nie je trochu bodom s negatívnym zaťažením, ktoré nasleduje presné obežné dráhy, ako napríklad elektrárne, ktoré si predstavil Rutherford.
Naopak, elektrón je rozptýlený V oblastiach okolo pozitívneho jadra, nazývaného atómové orbitály. Od neho môžeme vedieť pravdepodobnosť stretnúť sa v jednom alebo druhom štáte.
Napriek tomu model Rutherford znamenal obrovský pokrok v znalosti vnútornej štruktúry atómu. A prepadli cestu pre viac výskumných pracovníkov, aby ju naďalej zdokonalili.
Odkazy
- Andriessen, m. 2001. HSC. Fyzika 2. Jacaranda HSC Science.
- Arfken, G. 1984. Fyzika univerzity. Akademická tlač.
- Rytier, r. 2017. Fyzika pre vedcov a inžinierstvo: Strategický prístup. Pearson.
- Fyzika OpenLab. Experiment Rutherford-Geiger-Marsden. Získané z: PhysicsopenLab.orgán.
- Rex, a. 2011. Základy fyziky. Pearson.
- Tyson, T. 2013. Experiment v Rutherforde. Získané z: 122.Fyzika.Ucdavis.Edu.
- Xaktly. Rutherfordove experimenty. Obnovené z: xaktly.com.
- Wikipedia. Experiment Rutherford. Obnovené z: Je to.Wikipedia.orgán.
- « Charakteristiky výživy autotrofu, fázy, typy, príklady
- Biografia Anna Freud, teórie, obranné mechanizmy, diela »

