Terciárna štruktúra hlavných charakteristík
- 5130
- 1375
- JUDr. Rudolf Čapkovič
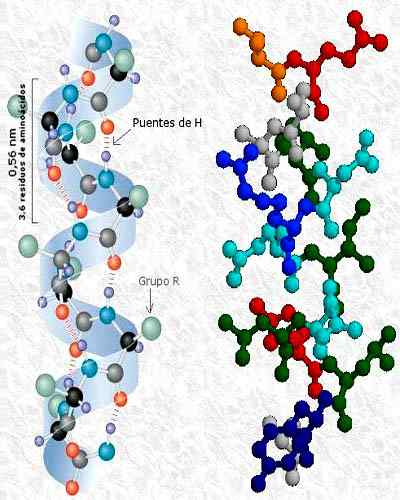
Ten Terciárna štruktúra proteínov Je to trojrozmerná konformácia, ktorú polypeptidové reťazce získavajú pri skladaní na sebe. Táto konformácia sa objavuje interakciami medzi bočnými reťazcami aminokyselinového odpadu polypeptidu. Bočné reťazce môžu interagovať nezávisle od ich polohy v proteíne.
Pretože to závisí od interakcií medzi skupinami R, terciárna štruktúra ukazuje neopätné aspekty reťazca, pretože tieto skupiny sa líšia pre každý zvyšok aminokyselín. Na druhej strane sekundárna štruktúra závisí od karboxylových a aminoskupín, ktoré sú prítomné vo všetkých aminokyselinách.
 Terciárna štruktúra proteínu kinázy fosfatázy, so sekundárnymi štruktúrami v alfa a beta liste. Prevzaté a upravené z: A2-33. Upravené Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Terciárna štruktúra proteínu kinázy fosfatázy, so sekundárnymi štruktúrami v alfa a beta liste. Prevzaté a upravené z: A2-33. Upravené Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Niektorí autori naznačujú, že vláknité proteíny majú jednoduchú terciárnu štruktúru, ale iní autori zdôrazňujú, že táto štruktúra je typická pre guľové proteíny.
[TOC]
Vláknité proteíny
V vláknitých proteínoch sú polypeptidové reťazce usporiadané vo forme dlhých vlákien alebo dlhých listov; Spravidla sa skladajú z jedinečného typu sekundárnej štruktúry. Táto sekundárna štruktúra je vo väčšine prípadov dôležitejšia ako terciárna štruktúra pri určovaní tvaru proteínu.
Jeho biologická funkcia je štrukturálna, udeľujúca silu a/alebo elasticitu orgánom a štruktúram, kde sa nachádzajú, a zároveň ich udržiavať pohromade. Všetky vláknité proteíny sú nerozpustné vo vode, kvôli veľkému množstvu hydrofóbnych aminokyselín, ktoré prezentujú.
Medzi tieto vláknité proteíny patria keratíny a kolagén. Prvé sa nachádzajú v spojivových tkaninách av štruktúrach, ako sú chĺpky, nechty (a-queratinas), váhy a perie (p-cheatíny). Medzitým sa nachádza kolagén.
α-quatinas
Tieto proteíny sú súčasťou tzv. Okrem toho sú hlavnou zložkou chĺpkov, nechtov, vlny, rohov, kopytá a jedného z hlavných proteínov živočíšnej kože.
Môže vám slúžiť: Kinyoun farbenieŠtruktúra molekuly je a vrtule. Dva pramene a-likratínu môžu byť usporiadané paralelne a zaregistrovať jeden nad druhý s ich hydrofóbnymi skupinami, ktoré medzi nimi interagujú. Týmto spôsobom sa vytvorí superhelská alebo guľová štruktúra s vinutím doľava.
Terciárna štruktúra aratínu je jednoduchá a dominuje jej sekundárna štruktúra a-helixu. Na druhej strane je prítomná kvartérna štruktúra, pretože dve molekuly sa zúčastňujú na superheliidálnej štruktúre, ktorá interaguje prostredníctvom nekovalentných väzieb.
P-Oquratinas
Primárna štruktúra je podobná štruktúre a-liquinas, ale jej sekundárnej štruktúre dominujú β hárky. Sú hlavným zložkou váh plazov a perie vtákov.
Kolagén
Tento proteín môže predstavovať viac ako 30% celkovej hmotnosti bielkovín niektorých zvierat. Nachádza sa v chrupavkách, kosťoch, šľachách, rohovke a koži, medzi inými tkanivami.
Sekundárna štruktúra kolagénu je jedinečná a predstavuje levogira vrtule s odpadom 3,3 aminokyseliny pre každé kolo pre každé kolo. Tri levogyózne reťazce vrtule (a).
Molekuly tropocollagénu sa spájajú a vytvárajú kolagénovú vlákno, ktorá má veľkú odolnosť, vyššiu ako oceľ a porovnateľná s vysoko rezistentnou meďou.
Ostatné vláknité proteíny
Ďalšími typmi vláknitých proteínov sú fibroín a elastín. Prvý z nich je tvorený β hárkami, hlavne vytvorenými Glycinou, alanínom a serínom.
Bočné reťazce týchto aminokyselín sú malé, takže ich môžu byť úzko zabalené. Výsledkom je vlákno, ktoré je veľmi rezistentné a veľmi nezvratné.
Môže vám slúžiť: fosfátový pufor (PBS): Nadácia, príprava a použitiaV elastíne medzitým valín nahrádza serín medzi hlavnými zložkami aminokyselín. Na rozdiel od fibroínu je elastin veľmi rozšíriteľný, odtiaľ jeho názov. V ústave molekuly pôsobí aj lyzín, ktorý sa môže podieľať na krížovom rozlíšení, ktoré umožňuje elastínu obnoviť jeho tvar, keď napätie prestane.
Guľometové proteíny
Globulárne proteíny, na rozdiel od vláknitého, sú rozpustné a vo všeobecnosti majú niekoľko typov sekundárnych štruktúr. V nich sú však dôležitejšie tri rozmerové konformácie, ktoré získavajú pri skladaní na sebe (terciárna štruktúra).
Tieto konkrétne trojrozmerné konformácie poskytujú každému proteínu špecifickú biologickú aktivitu. Hlavná funkcia týchto proteínov je regulačná, rovnako ako v prípade enzýmov.
Charakteristiky terciárnej štruktúry globulárnych proteínov
Terciárna štruktúra globulárnych proteínov má niektoré dôležité vlastnosti:
- Globulárne proteíny sú kompaktné vďaka baleniu, keď sa polypeptidový reťaz zloží.
- Vzdialený odpad aminokyseliny v primárnej štruktúre polypeptidových reťazcov je blízko a je schopný vzájomne interagovať kvôli skladaniu.
- Väčšie guľové proteíny (viac ako 200 aminokyselín) môžu mať niekoľko kompaktných segmentov, medzi nimi a s konkrétnymi funkciami, a každý z týchto segmentov sa nazýva doména. Doména môže mať odpad medzi 50 a 350 aminokyselinami.
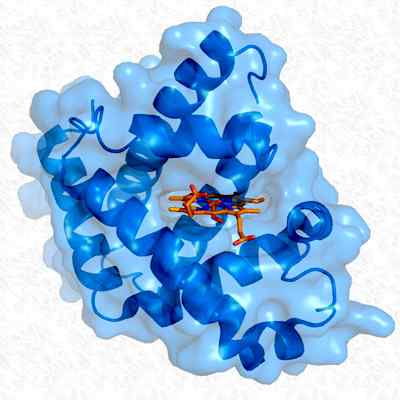 Terciárna štruktúra myoglobínu. Prevzaté a upravené z: Thomas Splettstoesser. Upravené Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Terciárna štruktúra myoglobínu. Prevzaté a upravené z: Thomas Splettstoesser. Upravené Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Všeobecné pravidlá skladania globálnych proteínov
Ako už bolo uvedené, proteíny majú osobitné skladacie formy, ktoré im dávajú osobitné vlastnosti. Toto skladanie nie je náhodné a uprednostňuje sa primárnou aj sekundárnou štruktúrou, ako aj niektorými nekovalentnými interakciami a existujú aj niektoré fyzické obmedzenia na skladanie, takže boli formulované niektoré pravidlá:
Môže vám slúžiť: primárne lymfoidné orgány- Všetky guľové proteíny majú definované vzory distribúcie, s hydrofóbnymi skupinami nasmerovanými do molekuly a hydrofilného odpadu vo vonkajšej vrstve vo vonkajšej vrstve. Na tento účel sú potrebné najmenej dve vrstvy sekundárnej štruktúry. Plučka p-a-β a a-a vrchol môžu prispievať týmto dvom vrstvám.
- Pytá β sú všeobecne usporiadané vo forme levogiry.
- V reťazci polypeptidu sa môžu vyskytnúť rôzne zákruty, ktoré sa pohybujú od sekundárnej k inej štruktúre, ako sú napríklad β alebo y zákruty, ktoré môžu byť schopné investovať smer reťazca do štyroch aminokyselinových odpadov alebo menej.
- Globulárne proteíny majú a, β hárky, nepravidelne štruktúrované zvraty a segmenty.
Denaturácia proteínu
Ak proteín stratí svoju natívnu (prírodnú) trojrozmernú štruktúru, stráca svoju biologickú aktivitu a väčšinu svojich špecifických vlastností. Tento proces je známy ako denaturácia.
Denaturácia sa môže vyskytnúť, keď sa zmenia prirodzené podmienky prostredia, napríklad rôznou teplotou alebo pH. Tento proces je v mnohých proteínoch nezvratný; Iní však môžu spontánne obnoviť svoju prirodzenú štruktúru obnovením normálnych podmienok prostredia.
Odkazy
- C.Klimatizovať. Mathews, K.A. Van Hold & K.G. Ahern (2002). Biochemery. 3. vydanie. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harperov biochemer. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biochemery. 5. vydanie. W. H. Freeman a spoločnosť.
- W.M. Becker, L.J. Kleinsmith & J. Hardin (2006) svet bunky. 6. vydanie. Pearson Education Inc.
- Do.Lehninger (1978). Biochémia. Omega Editions, s.Do.
- Tón. McKee & J.R. McKee (2003). Biochémia: molekulárny základ života. 3. vydanie. Spoločnosti McGraw-Hiii, Inc.
- « Vlastnosti, aplikácie a príklady fermionického kondenzátu
- Štruktúra sodného sodného (SDS) dodecilu, vlastnosti, používa »

