Sekundárna štruktúra charakteristických proteínov

- 3486
- 1004
- Valentín Dula
Ten Štruktúra sekundárneho proteínu Je to názov, ktorý definuje konformáciu zloženú lokálne z niektorých častí polypeptidového reťazca. Táto štruktúra pozostáva z niekoľkých vzorov, ktoré sa pravidelne opakujú.
Existuje mnoho spôsobov, ako sú reťazce proteínov zložené. Avšak iba niekoľko z týchto foriem je veľmi stabilných. V prírode sú najčastejšie formy, ktoré proteíny získavajú. Tieto štruktúry môžu byť opísané podľa uhlov prepojenia ψ (Psi) a φ (Phi) odpadu z aminokyselín.
 Schéma a model guľôčok a tyčí helixu proteínov Alfa (sekundárna štruktúra). Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Schéma a model guľôčok a tyčí helixu proteínov Alfa (sekundárna štruktúra). Prevzaté a upravené z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Interakcie stanovené medzi bočnými reťazcami odpadu z aminokyselín môžu pomôcť stabilizovať alebo naopak destabilizovať sekundárnu štruktúru proteínov. V konštitúcii mnohých vláknitých proteínov je možné pozorovať sekundárnu štruktúru.
[TOC]
História
V desaťročí 30. rokov minulého storočia, William Atsbury, ktorý pracoval s X -Rays, zistil, že vlasové bielkoviny, ako aj hroty porcozpínu, majú v segmentoch štruktúry, ktoré sa pravidelne opakovali.
Na základe týchto výsledkov a so znalosťou dôležitosti vodíkových väzieb v orientácii polárnych skupín peptidových väzieb, William Pauling a spolupracovníkov, a preto hypoteticky určili možné pravidelné konformácie, ktoré by proteíny mohli mať.
Pauling a jeho spolupracovníci v 50 -tych rokoch 20. storočia založili niekoľko postulátov, ktoré sa museli splniť v prepojeniach polypeptidových reťazcov, vrátane a na prvom mieste, že dva atómy sa nemôžu priblížiť k sebe vo vzdialenosti menšej ako ich vzdialenosť od ich príslušných Rádiá van der Waals.
Tiež naznačili, že na stabilizáciu skladania reťazcov sú potrebné nekovalentné väzby.
Môže vám slúžiť: sexuálna reprodukciaNa základe týchto postulátov a predchádzajúcich znalostí a použitia molekulárnych modelov sa im podarilo opísať niektoré pravidelné konformácie proteínov, vrátane, ktoré sa následne preukázali, že boli najčastejšie v prírode, ako napríklad vrtule a a lamina β β β β β β β β β β.
Vrtuľa α
Je to najjednoduchšia sekundárna štruktúra, kde je polypeptidový reťazec usporiadaný v zvinutom a zhutnenom tvare okolo imaginárnej osi. Okrem toho z tejto špirálovej kostry vynikajú bočné reťazce každej aminokyseliny.
Aminokyseliny sú v tomto prípade usporiadané tak, že majú uhly spojenia ψ Od -45 ° do -50 ° a φ z -60 °. Tieto uhly sa vzťahujú na spojenie medzi a uhlíkom a kyslíkom karbonylu a väzby medzi dusíkom a uhlíkom a uhlíkom každej aminokyseliny.
Vedci navyše zistili, že pre každú a vrtuľový zákrut je prezentovaný 3,6 aminokyselinový odpad a že tento ťah je vždy dextrogyry v proteínoch. Okrem toho, že je najjednoduchšou štruktúrou, je vrtuľou a prevládajú v a-queratíne a asi 25% aminokyselín globulárnych proteínov prijíma túto štruktúru.
A vpredu sa stabilizuje vďaka skutočnosti, že predstavuje početné vodíkové mosty. Preto sú v každom zákrute vrtule stanovené tri alebo štyri odkazy tohto typu.
V vodíkových mostík.
Vedci ukázali, že a propagácia a valca sa môže tvoriť s polypeptidovými reťazcami vytvorenými pomocou l- alebo d-aminokyselín, s podmienkou, že všetky aminokyseliny majú rovnakú konfiguráciu stereoizoméry. Okrem toho môžu prírodné L-eaminokyseliny tvoriť a droordy s pravou aj vľavo.
Môže vám slúžiť: imunoglobulín DNie všetky polypeptidy však môžu tvoriť stabilnú a vrtule, pretože ich primárna štruktúra ovplyvňuje stabilitu tohto. Racy R niektorých aminokyselín môžu destabilizovať štruktúru, čo bráni tvorbe vrtule α.
Β list
V liste β alebo v zloženom β hárku má každý z odpadu z aminokyseliny rotáciu o 180 ° vo vzťahu k predchádzajúcemu zvyšku aminokyselín. Týmto spôsobom sa získava, že kostra polytidového reťazca sa rozširuje a vo forme kľukatej alebo akordeónovej formy.
Polypeptidové reťazce s práškovým akordom môžu byť umiestnené v susedstve navzájom a produkujú lineárne vodíkové mosty medzi oboma reťazami.
Dva susedné polypeptidové reťazce môžu byť usporiadané paralelne, to znamená, že obidve môžu byť orientované v aminokarboxylovom smere a tvoria paralelný β list; o môžu byť umiestnené v opačných smeroch a potom tvoria β antiparalla list.
Bočné reťazce susedného aminokyselinového odpadu vynikajú z kostry reťazca v opačných smeroch, čo vedie k striedaniu vzoru. Niektoré proteínové štruktúry obmedzujú typy aminokyselín β štruktúr.
Napríklad v husto balených proteínoch sú častejšie aminokyseliny s krátkym reťazcom, ako je glycín a alanín na ich kontaktných povrchoch.
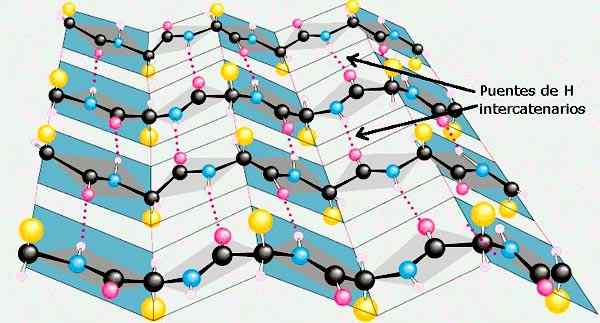 Β list sekundárnych štruktúr proteínov. Prevzaté a upravené z: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)].
Β list sekundárnych štruktúr proteínov. Prevzaté a upravené z: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Ostatné konformácie sekundárnej štruktúry
Špirála 310
Táto štruktúra sa vyznačuje prezentáciou 3 aminokyselinového odpadu na kolo. Táto štruktúra bola pozorovaná u niektorých proteínov, ale nie je príliš častá povaha.
Špirála
Táto štruktúra má medzitým 4,4 aminokyselinový odpad od špirálového zákruty a 16 -prvú slučku vodíkovej väzby. Aj keď je táto konfigurácia stericky možná, nikdy nebola v prírode pozorovaná.
Môže vám slúžiť: Dextrose Potato Agar: Nadácia, príprava a použitieMožnou príčinou môže byť jeho duté centrum, príliš veľké na to, aby umožnilo výkonnosť van der Waalsov, ktoré by pomohli stabilizovať štruktúru, avšak je príliš malý na to, aby umožnil priechod molekúl vody.
Štruktúra SuperScundaria
Supersekundárne štruktúry sú kombináciou sekundárnych štruktúr α a skladaných listov β β listov. Tieto štruktúry sa môžu vyskytnúť v mnohých guľkových proteínoch. Existujú rôzne možné kombinácie, z ktorých každá má osobitné vlastnosti.
Niektoré príklady štruktúr SuperSecundarias sú: jednotka Pαp, v ktorom sú dva paralelné β hárky spojené segmentom a vrtule; ten jednotka aα, charakterizovaný dvoma po sebe nasledujúcimi aicesmi, ale oddelenými ne -helikálnym segmentom, spojeným s kompatibilitou svojich bočných reťazcov.
Niekoľko β hárkov môže ustúpiť na seba, čo dáva konfiguráciu sudca β, zatiaľ čo β hárka antipaallala sa stiahla na to, či predstavuje štruktúru SuperSecundaria s názvom Grécky kľúč.
Odkazy
- C.Klimatizovať. Mathews, K.A. Van Hold & K.G. Ahern (2002). Biochemery. 3. vydanie. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harperov biochemer. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biochemery. 5. vydanie. W. H. Freeman a spoločnosť.
- J.Koolman & K.-H. Roehm (2005). Atlas z biochémie. 2. vydanie. Tok.
- Do. Lehninger (1978). Biochémia. Omega Editions, s.Do.
- Tón. McKee & J.R. McKee (2003). Biochémia: molekulárny základ života. 3Rd Vydanie. Spoločnosti McGraw-Hiii, Inc.
- « Elastické otrasy v rozmeroch, špeciálnych prípadoch, cvičeniach
- Súčasné charakteristiky hodnoty, vzorce a príklady »

