Lewisova štruktúra, z čoho sa skladá, ako sa to robí, príklady

- 3260
- 350
- Václav Višňovský
Ten Lewisova štruktúra Je to všetko, čo zastúpenie kovalentných väzieb v molekule alebo ióne. V ňom sú tieto väzby a elektróny reprezentované dlhými bodmi alebo skriptmi, hoci väčšinou body zodpovedajú nezdieľaným elektrónom a skriptom k kovalentným väzbám.
Ale čo je kovalentný odkaz? Je to zdieľanie niekoľkých elektrónov (alebo bodov) medzi dvoma atómami periodickej tabuľky. S týmito diagramami môžete naopakovať mnoho kostrov pre určitú zlúčeninu. Ktorý z nich je ten pravý, bude závisieť od formálneho zaťaženia a chemickej povahy rovnakých atómov.
 Zlúčenina 2-brómpropan. Ben Million [verejná doména], z Wikimedia Commons.
Zlúčenina 2-brómpropan. Ben Million [verejná doména], z Wikimedia Commons. Na vynikajúcom obrázku je príklad toho, čo je Lewisova štruktúra. V tomto prípade je zastúpená zlúčenina 2-brómpropano. Čierne body zodpovedajúce elektrónom je možné vidieť, tak tí, ktorí sa zúčastňujú na odkazoch, ako aj tých, ktoré nie sú zdieľané (jediný krútiaci moment tesne nad BR).
Ak by body „:„ boli nahradené dlhým skriptom “-“, potom by bola uhlíková kostra 2-brómpropanu reprezentovaná ako: C-C-C-C-C. Prečo namiesto „molekulárneho rámca“ by to mohlo byť C-H-H-C? Odpoveď spočíva v elektronických charakteristikách každého atómu.
Preto, pretože vodík má iba jeden elektrón a jeden orbitál, ktorý je k dispozícii na vyplnenie, iba kovalentná väzba. Preto nikdy nemôžete tvoriť dve väzby (nie sú zamieňané s vodíkovými mostmi). Na druhej strane elektronická konfigurácia atómu uhlíka umožňuje (a požiadavky) tvorba štyroch kovalentných väzieb.
Z tohto dôvodu musia byť Lewisove štruktúry, kde C a H musia byť konzistentné a rešpektujú to, čo sa riadi ich elektronickými konfiguráciami. Týmto spôsobom, ak má uhlík viac ako štyri väzby alebo vodík viac ako jeden, potom je možné vylúčiť náčrt a začať nového v súlade s realitou.
Práve tu sa objavujú niektoré z hlavných dôvodov alebo chrbtov týchto štruktúr, ktoré predstavil Gilbert Newton Lewis pri hľadaní molekulárnych reprezentácií verných experimentálnym údajom: molekulárna štruktúra a formálne zaťaženie.
Všetky existujúce zlúčeniny môžu byť reprezentované štruktúrami Lewisu, čo poskytuje prvý prístup k tomu, ako by mohla byť molekula alebo ióny.
[TOC]
Aká je Lewisova štruktúra?
Je to reprezentatívna štruktúra elektrónov vo Valencii a kovalentných väzbách v molekule alebo ióne, ktorá slúži na predstavu o svojej molekulárnej štruktúre.
Táto štruktúra však nedokáže predpovedať niektoré dôležité detaily, ako je molekulárna geometria vzhľadom na atóm a jej okolie (ak je štvorcová, plochá, bipiramidálna atď.).
Tiež nehovorí nič o tom, čo je chemická hybridizácia jeho atómov, ale tam, kde sú umiestnené dvojnásobné alebo trojité väzby a ak je v štruktúre rezonancia.
S týmito informáciami sa môžete argumentovať o reaktivite zlúčeniny, jej stabilite, ako a aký mechanizmus bude molekula nasledovať pri reagovaní.
Z tohto dôvodu Lewisove štruktúry nikdy neprestali brať do úvahy a sú veľmi užitočné, pretože môžu kondenzovať nové chemické učenie.
Ako sa to robí?
Na kreslenie alebo načrtnutie štruktúry, receptúry alebo diagramu Lewisa je nevyhnutný chemický vzorec zlúčeniny. Bez nej nemôžete ani vedieť, aké sú atómy, ktoré to tvoria. Akonáhle je s ňou, periodická tabuľka sa používa na lokalizáciu, ktoré skupiny patria.
Môže vám slúžiť: viskozita: príklady, príčiny, jednotky, typyNapríklad, ak máte zlúčeninu C14Ani2N3 Potom by sme museli hľadať skupiny, v ktorých je uhlík, kyslík a dusík. Urobil to, bez ohľadu na zlúčeninu, počet valenčných elektrónov zostáva rovnaký, takže skôr alebo neskôr si zapamätajú.
Uhlík teda patrí do skupiny DPH, kyslík do skupiny VIA a dusík do VA. Číslo skupiny sa rovná množstvu elektrónov (bodov) vo Valencii. Všetky majú spoločnú tendenciu dokončiť oktet vrstvy Valencie.
Aké je pravidlo oktetu?
To hovorí. Platí to pre všetky nemetalické prvky alebo tie, ktoré sa nachádzajú v blokoch S alebo P periodickej tabuľky.
Nie všetky prvky však riadia pravidlo oktetu. Konkrétne prípady sú prechodné kovy, ktorých štruktúry sú viac založené na formálnom zaťažení a ich počte skupiny.
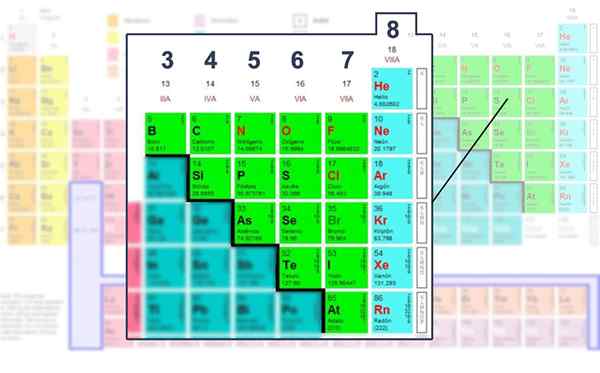 Počet elektrónov vrstvy Valencie nemetalických prvkov, v ktorých je možné prevádzkovať so štruktúrou Lewis.
Počet elektrónov vrstvy Valencie nemetalických prvkov, v ktorých je možné prevádzkovať so štruktúrou Lewis. Aplikácia matematického vzorec
Vedieť, ktorá skupina patria, a teda počet valenčných elektrónov, ktoré sú k dispozícii na vytvorenie odkazov, sa vytvorí nasledujúci vzorec, ktorý je užitočný pre kreslenie Lewisových štruktúr:
C = n - d
Kde c znamená zdieľané elektróny, to znamená, že tí, ktorí sa zúčastňujú na kovalentných dlhopisoch. Pretože každý odkaz sa skladá z dvoch elektrónov, potom sa C/2 rovná počtu odkazov (alebo skriptov), ktoré musia byť nakreslené.
N sú potrebné elektróny, Tí, ktorí musia mať atóm vo svojej vrstve Valencie, aby boli izolátormi pre ušľachtilý plyn, ktorý nasleduje v rovnakom období. Pre všetky iné prvky ako H (pretože vyžaduje, aby sa s ním porovnali dva elektróny), potrebujú osem elektrónov.
D sú dostupné elektróny, ktoré sú určené skupinami alebo elektrónovými číslami Valencie. Takže, ako CL patrí do skupiny VIIA, musí byť obklopená siedmimi čiernymi alebo elektrónmi a nezabudnite, že pár je potrebný na vytvorenie spojenia.
Mať atómy, ich body a počet odkazov C/2, potom je možné improvizovať štruktúru Lewis. Ďalej je však potrebné mať pojem iné „pravidlá“.
Kam umiestniť menej elektronických atómov
Čím menej elektronických atómov v drvivej väčšine štruktúr zaberá centrá. Z tohto dôvodu, ak máte zlúčeninu s atómami P, O a F, musí byť P v strede hypotetickej štruktúry.
Je tiež dôležité zdôrazniť, že hydrogény sú zvyčajne spojené s veľmi elektronegatívnymi atómami. Ak máte v zlúčenine Zn, H a O, H pôjde vedľa O a nie so Zn (Zn-O-H a No H-Zn-O). Existujú výnimky z tohto pravidla, ale zvyčajne sa vyskytujú pri atómoch nemetalických atómov.
Symetria a formálne zaťaženie
Príroda má vysokú preferenciu, aby spôsobili čo najsôvodnejšie molekulárne štruktúry. To pomáha vyhnúť sa zvyšovaniu nepokojných štruktúr, pričom atómy sú usporiadané takým spôsobom, že sa nepoddrží žiadny zjavný vzorec.
Môže vám slúžiť: teórie kyseliny: Arrhenius, Bronsted Lowry, LewisNapríklad pre zlúčeninu C2Do3, Kde A je fiktívny atóm, najpravdepodobnejšou štruktúrou by bola A-C-A-C-A. Všimnite si symetriu ich strán, obe odrazy druhého.
Pri kreslení Lewisových štruktúr, najmä pre ióny, hrajú dôležitú úlohu aj formálne zaťaženie. Odkazy sa teda môžu pridať alebo odstrániť tak, aby formálne zaťaženie atómu zodpovedalo celkovému zobrazenému zaťaženiu. Toto kritérium je veľmi užitočné pre zlúčeniny prechodných kovov.
Obmedzenia v pravidle oktetu
 Hliníkový reprezentácia trifluoridu, zlúčenina, ktorá je nestabilná. Oba prvky sa skladajú zo šiestich elektrónov, ktoré generujú tri kovalentné väzby, keď by mali byť osem na dosiahnutie stability. Zdroj: Gabriel Bolívar
Hliníkový reprezentácia trifluoridu, zlúčenina, ktorá je nestabilná. Oba prvky sa skladajú zo šiestich elektrónov, ktoré generujú tri kovalentné väzby, keď by mali byť osem na dosiahnutie stability. Zdroj: Gabriel Bolívar Nie všetky pravidlá sú splnené, čo nevyhnutne neznamená, že štruktúra je nesprávna. Typické príklady sú pozorované v mnohých zlúčeninách, kde sú zapojené prvky skupiny IIIA (B, AL, GA, IN, TL). Tu sa konkrétne považuje za hliníkový trifluóru (Alf3).
Potom použijete vyššie uvedený vzorec, máte:
D = 1 × 3 (atóm hliníka) + 7 x 3 (tri atómy fluóru) = 24 elektrónov
Tu na 3 a 7 sú príslušné skupiny alebo počet valenčných elektrónov dostupných pre hliník a fluorid. Potom, vzhľadom na potrebné elektróny n:
N = 8 × 1 (atóm hliníka) + 8 x 3 (tri atómy fluóru) = 32 elektrónov
A preto zdieľané elektróny sú:
C = n - d
C = 32 - 24 = 8 elektrónov
C/2 = 4 odkazy
Pretože hliník je najmenej elektronegatívny atóm, musí byť umiestnený do stredu a fluór iba vytvára spojenie. Vzhľadom na to máte štruktúru Lewis del Alf3 (horný obrázok). Zdieľané elektróny sú zvýraznené so zelenými bodmi, ktoré ich odlíšia od nekomparenovaných.
Aj keď výpočty predpovedajú, že existujú 4 odkazy, ktoré sa musia tvoriť, hliník nemá dostatok elektrónov a nie je tu tiež štvrtý atóm fluóru. Výsledkom je, že hliník nespĺňa pravidlo oktetu a táto skutočnosť sa neodráža vo výpočtoch.
Príklady Lewisových štruktúr
Jód
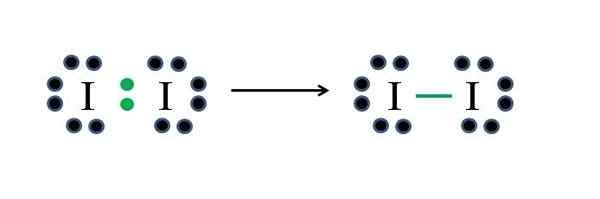 Non -metals jodo majú každý sedem elektrónov, takže zdieľaním jedného z týchto elektrónov generujú kovalentné puto, ktoré im dáva stabilitu. Zdroj: Gabriel Bolívar
Non -metals jodo majú každý sedem elektrónov, takže zdieľaním jedného z týchto elektrónov generujú kovalentné puto, ktoré im dáva stabilitu. Zdroj: Gabriel Bolívar Jód je halogén, a preto patrí do skupiny VIIA. Potom má sedem elektrónov vo Valencii a táto jednoduchá diatomická molekula môže byť reprezentovaná improvizáciou alebo použitím vzorca:
D = 2 × 7 (dva atómy jódu) = 14 elektrónov
N = 2 × 8 = 16 elektrónov
C = 16 - 14 = 2 elektróny
C/2 = 1 odkaz
Keďže 14 elektrónov 2 sa zúčastňuje na kovalentnom zväzku (zelené body a skript), 12 zostáva ako zdieľané; A pretože sú to dva atómy jódu, 6 musí byť distribuovaných pre jeden z nich (ich valenčné elektróny). V tejto molekule je možná iba táto štruktúra, ktorej geometria je lineárna.
Amoniak
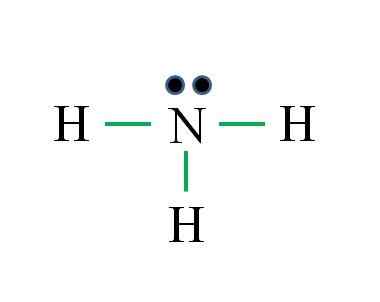 Dusík má 5 elektrónov, zatiaľ čo vodík iba 1. Dostatočné na dosiahnutie stability, keď sú stanovené tri kovalentné väzby, zložené z elektrónu N a ďalšieho zdroja H: Gabriel Bolívar
Dusík má 5 elektrónov, zatiaľ čo vodík iba 1. Dostatočné na dosiahnutie stability, keď sú stanovené tri kovalentné väzby, zložené z elektrónu N a ďalšieho zdroja H: Gabriel Bolívar Aká je Lewisova štruktúra pre molekulu amoniaku? Pretože dusík je zo skupiny VA, má päť elektrónov vo Valencii a potom:
Môže vám slúžiť: laboratórny teplomer: Charakteristiky, čo je pre, použitie, príkladyD = 1 x 5 (atóm dusíka) + 1 x 3 (tri atómy vodíka) = 8 elektrónov
N = 8 × 1 + 2 × 3 = 14 elektrónov
C = 14 - 8 = 6 elektrónov
C/2 = 3 odkazy
Tentoraz je vzorec pravý s počtom odkazov (tri zelené odkazy). Od 8 dostupných elektrónov 6 sa zúčastňujem na väzbách, nad atómom dusíka sa nachádza moment, ktorý sa nachádza nevýrazný krútiaci moment, ktorý sa nachádza.
Táto štruktúra hovorí všetko, čo by malo byť známe zo základne amoniaku. Uplatňovanie znalostí o TEV a TRPEV vyplýva, že geometria je tetraedrálna zdeformovaná voľným krútiacim momentom dusíka a že jeho hybridizácia je preto SP3.
C2H6Ani
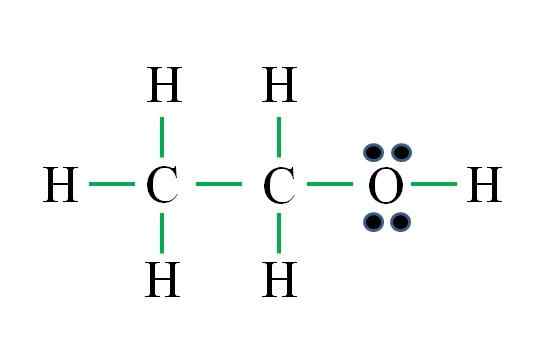 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Vzorec zodpovedá organickej zlúčenine. Pred použitím vzorca by sa malo pamätať na to, že hydrogény tvoria jednu väzbu, kyslík dva, uhlík štyri a že štruktúra musí byť čo najsôvodnejšia. Postupovanie ako predchádzajúce príklady sú:
D = 6 x 1 (šesť atómov vodíka) + 6 x 1 (atóm kyslíka) + 4 x 2 (dva atómy uhlíka) = 20 elektrónov
N = 6 x 2 (šesť atómov vodíka) + 8 x 1 (atóm kyslíka) + 8 x 2 (dva atómy uhlíka) = 36 elektrónov
C = 36 - 20 = 16 elektrónov
C/2 = 8 odkazov
Počet zelených skriptov zodpovedá 8 vypočítaným odkazom. Navrhovaná Lewisova štruktúra je štruktúra etanolu Ch3Chvály2Oh. Bolo by však správne navrhnúť štruktúru dimetyléteru3Okradnúť3, čo je ešte symetrickejšie.
Ktorý z nich je „správnejší“? Obe sú rovnako, pretože štruktúry vznikli ako štrukturálne izoméry toho istého molekulárneho vzorca C2H6Ani.
Permanganát
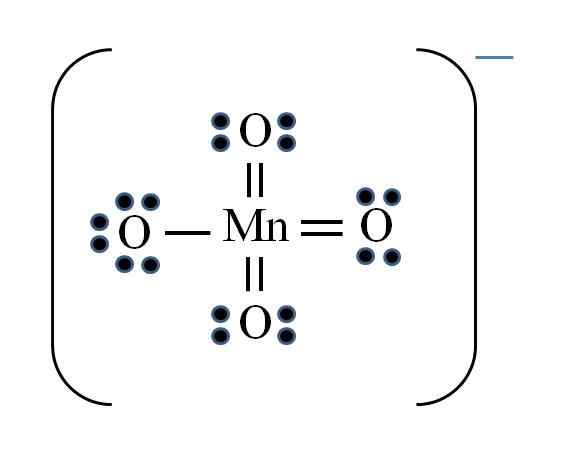 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Situácia je komplikovaná, keď chcete robiť Lewisove štruktúry pre zlúčeniny prechodných kovov. Mangán patrí do skupiny VIIB, medzi dostupné elektróny sa musí pridať aj elektrón negatívneho zaťaženia. Uplatňovanie vzorca, ktorý máte:
D = 7 × 1 (atóm mangánu) + 6 × 4 (štyri atómy kyslíka) + 1 elektrón na zaťaženie = 32 elektrónov
N = 8 × 1 + 8 × 4 = 40 elektrónov
C = 40 - 32 = 8 zdieľaných elektrónov
C/2 = 4 odkazy
Prechodné kovy však môžu mať vo Valencii viac ako osem elektrónov. Tiež pre ión MNO4- Vykazuje záporné zaťaženie, je potrebné znížiť formálne zaťaženie atómov kyslíka. Ako? Prostredníctvom dvojitých odkazov.
Ak sú všetky odkazy MNO4- Boli jednoduché, formálne zaťaženie kyslíka by sa rovnalo -1. Pretože existujú štyri, výsledné zaťaženie by bolo -4 pre anión, čo samozrejme nie je pravda. Keď sa vytvoria dvojité väzby, je zaručené, že jeden kyslík má záporné formálne zaťaženie, odrážané v ióne.
V permanganamátovom ióne je zrejmé, že existuje rezonancia. To znamená, že jediné jednoduché spojenie Mn-O je demokalizované medzi štyrmi atómami O.
Dikromato ión
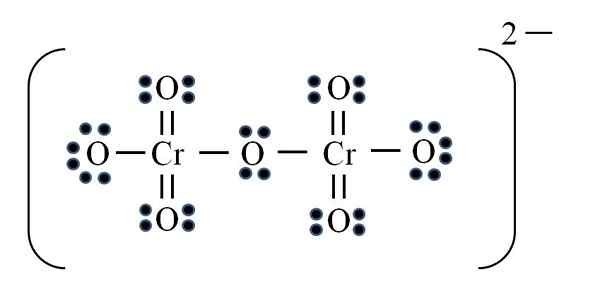 Zdroj: Gabriel Bolívar
Zdroj: Gabriel Bolívar Nakoniec sa podobný prípad vyskytuje s iónom dicromato (Cr2Ani7). Chróm patrí do skupiny VIB, takže má šesť elektrónov Valencie. Opäť aplikovanie vzorca:
D = 6 x 2 (dva atómy chrómov) + 6 x 7 (sedem atómov kyslíka) + 2 elektróny pomocou dvojité zaťaženie = 56 elektrónov
N = 8 × 2 + 8 × 7 = 72 elektrónov
C = 72 - 56 = 16 zdieľaných elektrónov
C/2 = 8 odkazov
Ale nie je tu 8 odkazov, ale 12. Z tých istých dôvodov sa v permanganátovom ióne musí dať dvoma kyslíkmi s negatívnym formálnym zaťažením, ktoré sa pridávajú rovnajúce sa -2, zaťaženie dikromato iónov.
Preto sa podľa potreby pridáva toľko dvojitých odkazov. Týmto spôsobom sa dostanete k Lewisovej štruktúre obrazu pre CR2Ani72-.
Odkazy
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie.). Cengage Learning, s. 251.
- Lewisove štruktúry. Prevzaté z: chemického.Chem.Purdue.Edu
- Steven a. Hardinger, Katedra chémie a biochémie, UCLA. (2017). Lewisova štruktúra. Prevzaté z: chem.UCLA.Edu
- Wayne Breslyn. (2012). Kreslenie Lewisových štruktúr. Prevzaté z: terpconnect.Umd.Edu
- Webmaster. (2012). Štruktúry Lewis („Electron Dot“). Katedra chémie, University of Maine, Orono. Zobraté z: chémie.Umeche.Main.Edu
- Lancaster, Sean. (25. apríla 2017). Ako určiť, koľko bodiek je na štruktúre Lewisovej bodky prvku prvku. Vedecký. Obnovené z: vedeckých.com

