Štruktúra plechovky, vlastnosti, získanie, použitia

- 3013
- 73
- MUDr. Miloslav Habšuda
On konzervovať Je to kov patriaci do bloku p periodickej tabuľky, ktorej chemický symbol je SN a ktorá sa nachádza v skupine 14, uhlíka. Napriek tomu, že je to široko používaný kov v celej ľudskosti od staroveku, pravdou je, že je to vzácny kov v zemskej kôre (2.3 ppm).
Je to strieborný, mäkký, ťažný a kovový kov. Má atómový počet 50 a jeho prevládajúce stavy alebo oxidačné čísla sú +2 (SN2+) a +4 (sn4+), Keďže sú zlúčeniny cínu (II), napríklad SNCL2, Dobré redukčné činidlá.
 Plechové alotropy. Zdroj: Zinn_9.JPG: Od: User: Tomihahndorf.Derivát.Org/licencie/By-SA/2.0)
Plechové alotropy. Zdroj: Zinn_9.JPG: Od: User: Tomihahndorf.Derivát.Org/licencie/By-SA/2.0) Tin má ako symbol SN, čo je skratka latinského slova „stannum“. Tin je kov odolný voči útoku vody a vzduchu pri teplote miestnosti; Ale v horúcom vzduchu tvorí plechový oxid, SNAM2.
Vlastnosť, že je odolná voči korózii a má nízky bod topenia, slúžila na početné aplikácie; ako napríklad povlak kovových povrchov a zváranie.
Cín má dve hlavné alotropné formy: biely a tuhý β tvar; a α, sivé a normálne prašné kontexty (krehkejšie). Preto je β forma najviac používaná v aplikáciách Tin.
Ďalšou dôležitou vlastnosťou cínu je jej schopnosť byť súčasťou zliatin s niekoľkými kovmi, najstarším bronzom, zliatinou medi a cínu.
[TOC]
Objavenie
 Plechové granule. Zdroj: Nephronus, CC0, cez Wikimedia Commons
Plechové granule. Zdroj: Nephronus, CC0, cez Wikimedia Commons Tin je kov, ktorý je známy už od staroveku. Preto nie je známe, kto bol jeho objaviteľ; A oveľa menej, rok a miesto jeho objavu.
Bronz je zliatinou medi s cínom a arzénom. Je možné, že rozpracovanie tejto zliatiny je dôsledkom náhodného a neúmyselného faktu, pretože prvé bronzové predmety - v dobe bronzovej - boli tvorené meďou a iba arzénnymi stopami.
Tieto objekty sa objavili na Blízkom východe, kde je arzén spojený s meďou. Ale od začiatku sa toxicita arzénu preukázala, čo dosiahne jeho nahradenie2).
Starí Gréci získaní cínu námorným obchodom a označovali zdroj svojej cínu ako „Cassiterides“, čo znamená „cínové ostrovy“. Je možné, že tieto ostrovy sa nachádzali v Cornuelles, British alebo Španielsku, kde sú veľké plechové ložiská.
Môže vám slúžiť: Bismuth subsalilicylate: Štruktúra, vlastnosti, použitie, efektyChemická plechová štruktúra
Ak sú dve alotropy: biela plechovka alebo β-SN a šedá plechovka alebo a-SN, budeme mať dve kryštalické štruktúry. P-SN je tetragonálny sústredený na telo (BCT), ktorý charakterizuje krutosť bielej plechovky.
Medzitým je štruktúra a-SN diamant; to znamená, že atómy SN sú spojené s tvorbou tetraedra sietí, bez existencie kovovej väzby.
Cín tiež predstavuje ďalšie dve alotropy za rôznych tlakových podmienok (v poradí GPA) a teplota (nad 161 ° C): σ-SN a Y-SN.
Elektronická konfigurácia
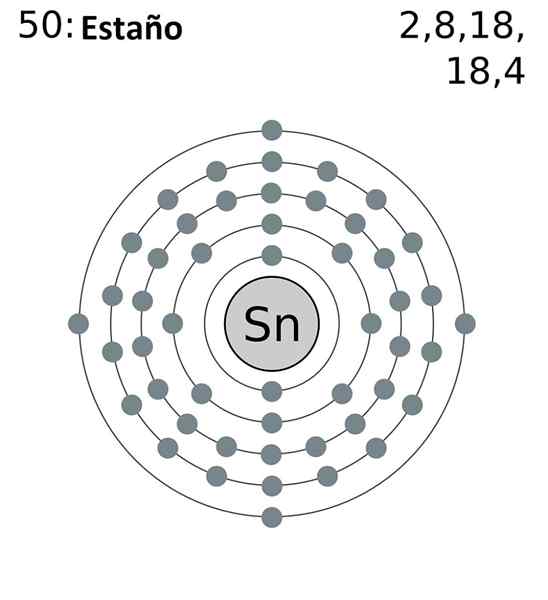
Elektronická konfigurácia skrátená Tin je nasledovná:
[KR] 4D10 5s2 5 P2
Pridaním všetkých elektrónov budeme mať celkom 14, rovnaké číslo, ktoré zodpovedá vašej skupine. Avšak iba elektróny orbitálov 5S a 5p sú tie, ktoré sa podieľajú na chemických reakciách cín.
Cínové vlastnosti
Vzhľad a fyzikálne vlastnosti
Tin je mäkký, ťažký a kovový kov, ktorý môže byť studený a točenie. Jeho nízka teplota topenia umožňuje priľnúť na čistenie povrchov kovov alebo zliatin, ako je oceľ, meď a jej zliatiny, čím ich chránia pred oxidáciou.
Keď sa zloží plechový kúsok, strihá sa a vydáva charakteristický zvuk známy ako „cínový výkrik“, čo je dôsledok rozdrveného kryštálov.
Tin má dve alotropné formy: β a α. Forma β zodpovedá bielej pevnej látky a je zodpovedná za aplikácie TIN; Zatiaľ čo a forma je šedijský prášok.
 Poloha v periodickej tabuľke. Zdroj: Obrázok od Daniela Mayera alebo Greatpattona a vydaný za podmienok GNU FDL
Poloha v periodickej tabuľke. Zdroj: Obrázok od Daniela Mayera alebo Greatpattona a vydaný za podmienok GNU FDL Forma β je prezentovaná pri teplotách nad 13.2 ° C. Keď teplota klesne 13.2 ° C, zmeny Tin z β formy do formy a. Tento jav je nežiaduci a vyhýba sa mu pridaním ďalších kovov do cínu, ako je antimón alebo bizmut, ktorý blokuje túto zmenu a predlžuje jej životnosť.
Tin je prvý supravodič známy pri teplotách pod 3.72 K.
Atómové číslo
päťdesiat
Molárna hmota
118.71 g/mol
Bod topenia
231.93 ° C
Bod varu
2602 ° C
Hustota
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Oxidačné stavy
Tin má viac oxidačných stavov: -4, -3, -2, -1, 0, +1, +2, +3, +4. Väčšina ich zlúčenín má však plechovku s oxidačnými stavmi +2 (SN2+) a +4 (sn4+).
Môže vám slúžiť: organické zlúčeninyIonizačné energie
Po prvé: 708.6 kJ/mol
Po druhé: 1411.8 kJ/mol
Tretie: 2943.0 kj/mol
Elektronegativita
1.96 v Pauling Scale
Reaktivita
Tin je kov odolný voči pôsobeniu vzduchu a vody pri teplote miestnosti, ale keď sa zahrieva vo vzduchu, tvorí oxid cín (IV), SNAM2, čo je slabo kyslé. Napadne ho kyseliny a alkalis a v prítomnosti kyslíka môže v niektorých prípadoch pôsobiť ako katalyzátor.
Získanie
 Casiterite Mineral je hlavný plechový mineralogický zdroj. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Casiterite Mineral je hlavný plechový mineralogický zdroj. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Cín z hľadiska jeho výskytu je zriedkavý kov, pretože má hojnosť v zemskej kôre iba 2 ppm. Casiterite Mineral, minerál oxidu cínu, je jediným komerčným zdrojom cínu.
Casiterite je načervený minerál, ktorý sa nachádza v bahnitých areál na brehoch riek. Cín je extrahovaný z kasiteritu zahrievaním až 1370 ° C uhlím alebo koksom, aby sa vytvorilo jeho zníženie.
Produkovaný cínu je nečistý, takže sa ošetrí hydroxidom sodným alebo kyselinou chlorovodíkovou na rozpustenie cínu. Potom je to vystavené elektrolýze, ktorá je cínovou anódou a železnou katódou. Cín je uložený na katóde s čistotou vyššou ako 90%.
Použitie/aplikácie
Ochrana proti korózii
Cín je kov odolný voči korózii. TO -CALLED CAN alebo CIN je oceľová nádoba, pokrytá cínovou vrstvou, aby sa predišlo oxidácii.
Plechovky sa používali na skladovanie potravín a iných látok, napríklad: obrazy, lakky, rozpúšťadlá atď. V súčasnosti sú však nahradené hliníkovými alebo plastovými nádobami. Potrubné potrubia a ventily udržiavajú čistotu vody a nápojov.
Zliatiny
 Prvé použitie pre zliatiny Tin boli výrobu kontajnerov alebo náčiní, ako sú plechovky a džbány tejto špajze. Zdroj: Motýľové plavby - Serge Ouachée/CC od -sa (https: // creativeCommons.Org/licencie/By-SA/3.0)
Prvé použitie pre zliatiny Tin boli výrobu kontajnerov alebo náčiní, ako sú plechovky a džbány tejto špajze. Zdroj: Motýľové plavby - Serge Ouachée/CC od -sa (https: // creativeCommons.Org/licencie/By-SA/3.0) Muž začal používať bronz viac ako 5 000 rokov. Bronz je zliatinou medi a cínu, ktorá sa používa pri vypracovaní nástrojov, zbraní, domácich náčiní.
Rovnakým spôsobom sa na výrobu hrncov, tanierov atď. Ale vzhľadom na toxicitu vedenia, Peel sa v súčasnosti vyrába s cínovou, antimónnou a kobaltovou zliatinou.
Môže vám slúžiť: kyselina hypoyodózna (HIO)Zliatina a olovo cínu majú nízky bod topenia, vlastnosť, ktorá umožnila jeho použitie pri zváraní, technika, ktorá slúži na zostavenie kusov prítomných v elektrických a elektronických obvodoch. Existujú autá, v ktorých je plechová zliatina so železom, zatiaľ čo sa používajú v leteckých vozidlách hliníka, cínu a zliatiny titánu.
Zliatiny cirónia, tiež nazývané zircaloys, sa používajú v jadrových reaktoroch a majú malé množstvo plechovky.
 Vzorky plechovky. Zdroj: Ondřej Manggl, verejná doména, cez Wikimedia Commons
Vzorky plechovky. Zdroj: Ondřej Manggl, verejná doména, cez Wikimedia Commons Zliatina striebra a cínu sa používa v zubných amalgámoch.
Kryštalická zliatina s prvkom Niobio je supravodič, ktorý pracuje pri teplote 18 K a udržuje svoju vlastnosť v silnom magnetickom poli.
Pohár
Cín sa používa v procedúre Pilkington na výrobu okna skla. Roztavené sklo je umiestnené na roztavenom cínovom povrchu a získa sklo plochý a hladký povrch. Táto technika sa stále používa úspešne.
Cínové soli sa postriekajú na sklo, aby sa získala vodivé napájacie podšívka, ktorá je schopná použiť na výrobu osvetľovacích panelov a čelného skla bez mrazu.
Zlúčenina
Hriešny chlorid (SNCL2) Používa sa v plechovom galvanizovanom a ako redukčné činidlo pri výrobe polymérov a farbív. Cínový fluorid (SNF2) Je to aktívna zložka v zubných pastoch.
Medzitým je jeho oxid užitočným katalyzátorom v určitých priemyselných procesoch. Okrem toho sa používa ako prášok do poľskej ocele.
Organické cínové zlúčeniny sa používajú ako biocídy a fungicídy, ktoré sú toxické pre ľudí. Organické stabilizátory cínu sa používajú na zabránenie zmien v polyvinylchloridu v dôsledku vystavenia svetla a teploty.
Chlorid Isñico (SNCL4) sa používa ako stabilizátor parfumov a ako východiskový materiál pre iné plechové solí.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Konzervovať. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie (2020). Konzervovať. PubChem Comunund Zhrnutie pre CID 23974. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- DR. Doug Stewart. (2020). Fakty o plechových prvkoch. Získané z: Chemicool.com
- Redaktori Enyclopaedia Britannica. (2020). Konzervovať. Získané z: Britannica.com
- Bell, Terence. (26. augusta 2020). Vlastnosti, výroba a aplikácie cínu. Zotavené z: Thoughtco.com
- Šošovica B.Vložka. (2020). Konzervovať. Získané z: Lentech.com
- Stephanie Pupas. (28. júla 2015). Fakty o cínu. Zotavené z: Livescience.com
- Zborník konferencie AIP. (9. februára 2018). Obnova cínu z plechovej trosky pomocou metódy elektrolýzy. doi.org/10.1063/1.5024070

