Rovnováha kvapaliny

- 3069
- 524
- Blažej Hrmo
Čo je to za rovnováhu kvapaliny?
On rovnováha kvapaliny Je to dynamický stav, ktorý vytvára tekutinu, či už ide o čistú látku alebo zmes, s parou, ktorá obklopuje a interaguje s jej povrchom. Aby sa uskutočnil nádoba.
Keď je systém zatvorený, tlak vyvíjaný molekulami parnej fázy bude v priebehu času stúpať. Bod príde tam, kde sa tlak zastaví; Toto je tlak pár kvapaliny, ktorý je fyzickou vlastnosťou záležitosti, ktorá je nezávislá od veľkosti nádoby alebo objemu kvapaliny.
 Keď sa odkryje plynový nápoj, je narušená jeho rovnováha kvapaliny a vapor, čo spôsobuje nerovnováhu tlakov mimo fľaše a s ním bubb. Zdroj: Openstax, CC po 4.0, cez Wikimedia Commons
Keď sa odkryje plynový nápoj, je narušená jeho rovnováha kvapaliny a vapor, čo spôsobuje nerovnováhu tlakov mimo fľaše a s ním bubb. Zdroj: Openstax, CC po 4.0, cez Wikimedia Commons Každá kvapalina, čistá alebo zmiešaná, bude mať pridružený tlak pár, ktorý bude závisieť od volatility jej zložiek; A preto z intermolekulárnych síl, ktoré ich držia pohromade v tekutine a na ich povrchu.
Tento tlak sa dá opísať predpokladom ideality roztokov alebo miešateľnosti komponentov zmesi. Za týmto účelom je použitie binárnych diagramov veľmi užitočné, v ktorom je možné uvažovať o životaschopnosti procesu separácie.
Rovnováha kvapaliny-Voper je nevyhnutná pre nekonečné procesy chemického inžinierstva, ako sú frakčné destilácie a tie, ktoré sú vyrobené z vodnej pary, prostredníctvom ktorých sa destiluje destilovaná v najprchavejších zložkách. Toto je prípad etanolu na 95.4% vo vode, čo je najprístupnejšie a najkonomómnejšie percento alkoholu na trhu.
Čisto látka
Molekuly čistej látky nie sú stále, ale prechádzajú z jedného miesta na druhé vďaka vnútornej kinetickej energii. Táto energia môže byť niekedy dostatočne veľká na prekonanie intermolekulárnych síl, ktoré „vytiahnú“ molekulu z konkrétneho do lona kvapaliny. Potom molekula unikne z povrchu kvapaliny do parnej fázy.
V parnej fáze sa molekuly zrazia s vnútornými stenami nádoby, vyhrávajú alebo strácajú rýchlosť, až kým sa nebudú stretávať s povrchom kvapaliny, kde akonáhle idú na integráciu konglomerátu molekúl tekutej fázy.
Môže vám slúžiť: kobalt: štruktúra, vlastnosti, aplikácieČas teda prebieha, kým sa pri určitej teplote (povedzme 25 ° C), počet molekúl, ktoré unikajú povrchu, sa rovná tým, ktoré vstupujú z pary. Preto sa uvádza, že v čistej látke bola stanovená rovnováha kvapalinovej váhy.
Tlak pár, aby zažili vnútorné steny nádoby, ako aj povrch kvapaliny, sa rovná PDo°, čo je konštantné a reprodukovateľné; Bez ohľadu na to, aký veľký alebo malý je nádoba ani objem kvapaliny, ktorá sa má uvažovať.
Zmesi
V kvapalinových zmesiach bude tiež zložka, ktorá vyvíja tlak na povrch kvapaliny a kontúry nádob. Váš tlak pary, ako sa dá očakávať, sa bude skladať z príspevkov z každej z komponentov zmesi, aby sme povedali, dve látky A a B. Tieto zmesi môžu byť miešateľné, čiastočne miešateľné.
Mizerný
V miešateľnej zmesi medzi A a B tvoria obe látky jednu fázu, ktorá na prvý pohľad vyzerá ako čistá látka. Podľa Daltonovho zákona sa teda tlak zmesi alebo roztoku rovná:
Pslnko = PDo + PB +··· PJo
Byť pJo akákoľvek iná zložka, ktorá je tiež prítomná v zmesi. Všimnite si, že PDo≠ pDo°, to znamená, že tlaky látok v zmesi nie sú rovnaké ako tlaky ich stavov s vysokou čistotou.
Ak za predpokladu, že riešenie je ideálne, rozdiely medzi interakciami A, B-B a A-B sú zrejmé. Toto sa dá aplikovať napríklad v zmesi etanolu a metanolu.
Preto tlaky pary komponentov v zmesi budú závisieť od ich relatívnych množstiev v kvapalnej fáze, vyjadrené ako molárne frakcie xJo. A tu zasahuje Raaultov zákon, ktorý sa snaží spojiť tlak PDo A pDo°:
PDo = XDo PDo°
Teraz je celkový tlak rovný:
Pslnko = XDo PDo° + xB PB° +···
Fáza pary, na druhej strane, bude mať svoje vlastné kompozície vyjadrené ako molárne frakcie Yi:
Yi = pJo / Pslnko
= XJo PJo° / pslnko
Binárny diagram
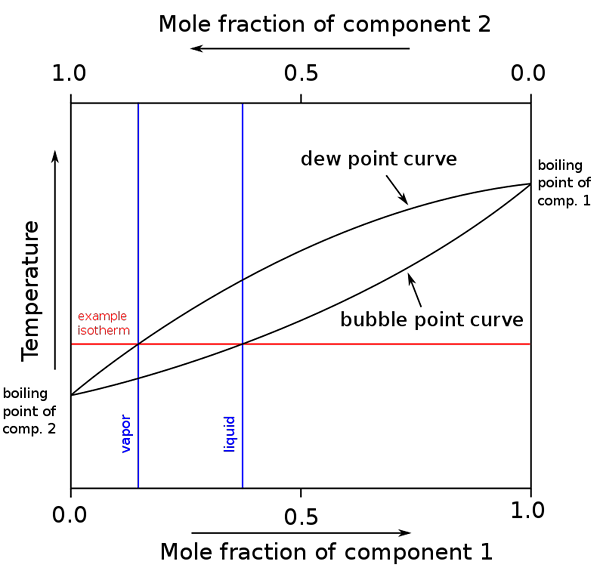 Schéma bodov varu a molárnych kompozícií pre binárnu zmes. Zdroj: binary_boiling_point_diagram.PNG: H PADLECKASDERIVATÍVNA PRÁCA: MICHBICH, CC BY-SA 2.5, cez Wikimedia Commons
Schéma bodov varu a molárnych kompozícií pre binárnu zmes. Zdroj: binary_boiling_point_diagram.PNG: H PADLECKASDERIVATÍVNA PRÁCA: MICHBICH, CC BY-SA 2.5, cez Wikimedia Commons Ak sú molárne frakcie zložiek binárnej zmesi (a + b) grafické, v závislosti od teploty alebo tlaku sa získajú binárne diagramy (pozri vyššie). Táto konkrétna forma, najjednoduchšia, zodpovedá forme ideálnych riešení.
Môže vám slúžiť: molárny objem: koncept a vzorec, výpočet a príkladyPlocha nad „oválnym“ zodpovedá fáze pary, zatiaľ čo oblasť nižšie zodpovedá kvapalnej fáze zmesi. Všimnite si, že keď molárna frakcia zložky 1 alebo je 0 (x1= 0), molárna frakcia zložky 2 alebo B sa bude rovnať 1 (x2= 1) a potom tlak pary dlhuje iba b. Táto teplota sa stáva bodom varu B.
Medzitým, na druhom konci (vpravo), keď x2= 0 Ale x1= 1, tlak pary je iba. Táto teplota sa stáva teplotou svojho bodu varu.
Spodná oválna čiara zodpovedá bublinkovým bodom, ktorý je v čase, keď sa prvá bublina objaví, keď sa kvapalná zmes zahrieva (stúpajúca po diagrame). A horná čiara zodpovedá rosnému bodu, ktorý je v čase, keď sa fáza pary ochladí a objaví sa prvá kvapka (klesá v diagrame).
Azeotropos
V mnohých neipeálnych roztokoch budeme mať azeotrops, ktoré sú zmesami, ktoré sa odparujú udržiavaním ich zloženej konštanty; to znamená, že sa odparujú, akoby to bola čistá zlúčenina.
Nie je možné „prelomiť“ azeotropné kompozíciu prostredníctvom väčších krokov destilácie. Namiesto toho sa na zvýšenie čistoty požadovanej komponentu používajú iné metódy.
Napríklad zmes etanol-voda tvorí azeotropicu s 95 zložením.4 etanolu. To znamená, že prostredníctvom destilácií nie je možné získať etanol s koncentráciou vyššou ako 95.4%; Vždy bude 4.6% zostávajúca voda. Ak ste chceli pripraviť absolútny etanol (100%), bolo by potrebné používať dehydratačné materiály alebo iné syntetické trasy.
V binárnom diagrame vidíme prítomnosť azeotropu, ktorá predstavuje nasledujúcu formu:
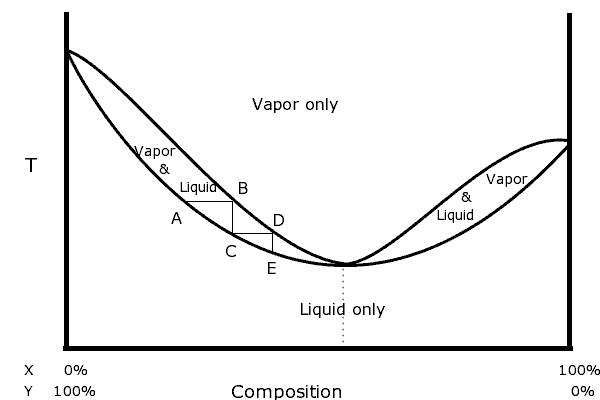 Binárny diagram zmesi s pozitívnym azeotropným. Zdroj: Karlhahn na anglickej Wikipédii, verejná doména, cez Wikimedia Common
Binárny diagram zmesi s pozitívnym azeotropným. Zdroj: Karlhahn na anglickej Wikipédii, verejná doména, cez Wikimedia Common Naľavo od diagramu je zrejmé, že v rámci „oválneho“, v oblasti, v ktorej máme rovnováhu kvapaliny-vapor, môžeme destilovať po sebe idúci Zmes v najprchavejšej zložke (x pre tento diagram).
V azeotropnom bode však zmes x a y a varí, akoby to bola jediná látka, takže nezáleží na tom, koľko destilácií sa vyrába, tekutina aj para budú mať rovnaké zloženie.
Môže vám slúžiť: Molekulárny vzorec: Ako ho dostať von, príklady a cvičeniaČiastočne
V čiastočne miešateľných zmesiach, ktoré sa vytvoria, v závislosti od teploty, dve rozpoznateľné fázy: jedna bohatá na zložku A a druhá bohatá na zložku B. Binárne diagramy pre tieto prípady sú oveľa prísnejšie a široké, pretože zahŕňajú regióny, v ktorých parná koexistuje spolu s týmito dvoma fázami.
Nemiešateľný
Keď hovoríme o nemiešateľných zmesiach, každá zložka sa bude správať, akoby bola v stave vysokej čistoty, pretože sotva interaguje s ostatnými molekulami. Tlak pary pre tieto zmesi sa preto bude rovnať:
Pslnko = PDo° + PB° +··· pJo°
Zmes sa uvarí pri teplote nižšej ako pri čistých komponentoch, pretože tlak nemiešateľnej zmesi bude vyšší, pretože sa rovná súčtu tlakov každej zložky v jeho čistom stave. Viac tlaku pary znamená, že je prchavejší, a preto sa uvarí pri nižšej teplote.
Žiadosti
Destilácia
V destiláciách, najmä na priemyselnej úrovni, sú znalosti o rovnováhe kvapaliny a kvapaliny primárne. Z komponentov zmesi a jej fázových diagramov je možné vypočítať, koľko jedál je potrebných pri konštrukcii frakcionačnej veže na správne oddelenie uvedených komponentov.
Destilácia vodnej pary
Vodná pary sa môžu čerpať vo vnútri zmesi pri destilácii. Keď bublajúca vodná para vo vnútri kvapaliny sa zvýši tlak pary v zmesi, takže sa uvarí pri nižšej teplote a pomôže extrahovať najprchavejšie komponenty (napríklad esencie).
Vták
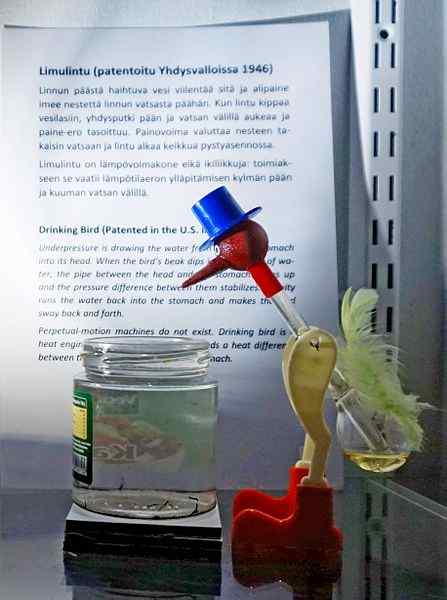 Pitie vtáka, jedna z najnáročnejších hračiek všetkých čias. Zdroj: Tiia Monto, CC BY-SA 4.0, cez Wikimedia Commons
Pitie vtáka, jedna z najnáročnejších hračiek všetkých čias. Zdroj: Tiia Monto, CC BY-SA 4.0, cez Wikimedia Commons Aj keď to nie je presne rovnováha kvapaliny-vapor, pravdou je, že za operáciou pitného vtáka je skryté niekoľko termodynamických javov.
Keď je hlava vtáka mokrá, začne sa ochladiť, keď sa voda odparuje. Toto zníženie teploty spôsobuje zníženie tlaku vo vnútri vtáčej hlavy. Metylénchlorid, ktorý sa nachádza na spodnej časti vtáka, sa bude snažiť vyrovnať tlaky a prúdiť cez sklenenú trubicu, ktorá spája hlavu s hlavou.
Kvapalina vystúpi na hlavu vtáka, vďaka čomu je ťažšia a nakloní svoje telo vpred. Vták potom „piť vodu“ a tlaky pary budú vyvážiť. Vyvážiť tlaky, vták vtáka sa vráti do vertikálnej polohy a cyklus sa bude opakovať, zatiaľ čo voda hlavy sa znova odparuje.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Walter J. Moore. (1962). Fyzikálna chémia. (Štvrté vydanie). Longmans.
- Wikipedia. (2020). Rovnováha. Zdroj: In.Wikipedia.orgán
- Ed Vitz a kol. (5. novembra 2020). Rovnováha. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Limer Eric. (30. januára 2018). Absurdne podrobné vysvetlenie hračky na pitie vtákov. Získané z: populárnejMechaniky.com
- University of Alicante. (s.F.). Téma 4: Výpočet rovnováhy-vapor. Rovnovážny diagram. [PDF]. Získané z: rua.Ua.je

