Reakčná entalpia, termochémia, cvičenia

- 3091
- 926
- MUDr. Miloslav Habšuda
Ten reakcia Je to termodynamická funkcia, ktorá vám umožňuje vypočítať zisk alebo dodanie tepla do chemickej reakcie za predpokladu, že k tejto reakcii došlo pri konštantnom tlaku. Je definovaná ako vnútorná energia alebo plus produkt tlaku p objemu V látok zapojených do chemickej reakcie: h = u + p ∙ V
Preto Entalpia má rozmery energie a v medzinárodnom systéme opatrení sa meria v jouloch. Na pochopenie vzťahu entalpie s tepla vymeneným v chemickej reakcii je potrebné pamätať na prvý zákon termodynamiky, ktorý stanovuje nasledujúce: q = ΔU + w
 postava 1. Pri spaľovaní plynu enldalpia klesá. Zdroj: Pixabay
postava 1. Pri spaľovaní plynu enldalpia klesá. Zdroj: Pixabay Prvý zákon ustanovuje, že teplo vymieňané v termodynamickom procese sa rovná variácii vnútornej energie látok zapojených do procesu plus práce vykonávanú týmito látkami v tomto procese.
V akomkoľvek procese W sa vypočítava podľa nasledujúceho vzťahu:

V predchádzajúcom výraze VI je počiatočný objem, vf konečný objem a p tlak. Ak sa proces vykonáva pod konštantným tlakom P, výsledná práca bude:
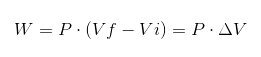
Kde ΔV je variácia objemu.
[TOC]
Definícia
Chemické reakcie sú termodynamické procesy, ktoré sa vo všeobecnosti vyskytujú pri konštantnom tlaku a veľmi často pri atmosférickom tlaku. Tento typ termodynamických procesov sa nazýva „izobarický“, pretože sa vyskytuje pri konštantnom tlaku.
V tomto prípade možno prvý zákon termodynamiky napísať takto:
QP = ΔU + P ∙ ΔV
Kde QP naznačuje, že teplo sa vymenilo za konštantného tlaku. Ak je definícia entalpie H = u + p ∙ V získaná, potom:
QP = ΔH
Odtiaľ musíte zmeniť pozitívnu entalpiu, ktorá naznačuje reakciu, ktorá vzala teplo z prostredia. Toto je endotermická reakcia.
Môže vám slúžiť: Ton: Transformácie, rovnocennosti a cvičenia vyriešenéNaopak, ak je zmena entalpie negatívna, potom je to exotermická reakcia.
V skutočnosti slovo entalpia pochádza z gréckeho slova Entalpien, ktorého význam je „teplo“.
Často sa entalpia nazýva tiež teplo. Je však zrejmé, že to nie je to isté ako teplo, ale je to výmena tepla počas termodynamického procesu, ktorá mení entalpiu.
Príručka
Na rozdiel od tepla je entalpia štátnou funkciou. Ak sa vypočíta zmena entalpie, vypočíta sa rozdiel dvoch funkcií, ktoré závisia výlučne od stavu systému, ako je vnútorná energia a objem.
ΔH = ΔU + P ∙ ΔV
Rovnako ako v reakcii zostáva tlak konštantný, takže reakčná entalpia je stavová funkcia, ktorá závisí iba od vnútornej energie a objemu.
Pri chemickej reakcii možno entalpiu reagencií definovať ako súčet súčtu každého z nich; a výrobky ako súčet entalpie všetkých výrobkov.
Zmena entalpie v reakcii je rozdiel v zmene produktov s výnimkou zmeny reagencií:

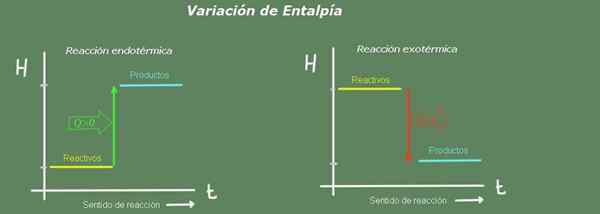 Obrázok 2. Entalpia. Zdroj: Self Made.
Obrázok 2. Entalpia. Zdroj: Self Made. Pri endotermickej reakcii je entalpia produktov väčšia ako entágová reagencia; to znamená, že reakcia berie teplo z životného prostredia. Naopak, pri exotermickej reakcii je entalpia reagencií väčšia ako v prípade produktov, pretože reakcia dáva životnému prostrediu teplo.
Štandardná entalpia
Pretože zmena entalpie v chemickej reakcii môže závisieť od tlaku a teploty, je obvyklé definovať štandardné reakčné podmienky:
Môže vám slúžiť: Kalibračná krivka: Na čo je to, ako to urobiť, príkladyŠtandardná reakčná teplota: 25 ° C.
Štandardný reakčný tlak: 1 bankomat = 1 bar.
Štandardná entalpia sa označuje nasledovne: H °
Termochémia
V termochemickej rovnici nielen látka a výrobky. Entalpia sa chápe ako reakcia na zmenu jej, ktorá mala miesto v tom istom.
Ako príklad pozrime nasledujúce reakcie:
2 H2 (plyn) + O2 (plyn) → 2 H2O (kvapalina); ΔH ° = -571,6 kJ (exotermický).
H2 (plyn) + (½) O2 (plyn) → H2O (kvapalina); ΔH ° = -285,8 kJ (exotermický).
2 H2O (kvapalina) → 2 H2 (plyn) + O2 (plyn); ΔH ° = +571,6 kJ (endotermický).
Entalpia je rozsiahle termodynamické množstvo
Ak sa výrazy chemickej rovnice vynásobia alebo vydelené určitým faktorom, potom sa ním vynásobí alebo vynásobí entalpia.
Ak je reakcia investovaná, investuje sa aj príznak reakčnej entalpie.
Vyriešené cvičenia
-Cvičenie 1
C2H2 acetylénový plyn sa získava z karbidovej reakcie CAC2, ktorá prichádza granulovaným spôsobom s vodou v prostredí a environmentálnym tlakom.
Ako údaje existujú entalpie tvorby činidiel:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
A entalpia tvorby produktu:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Nájdite štandardnú entropiu reakcie.
Riešenie
Prvá vec je zvýšiť vyváženú chemickú rovnicu:
CAC2 (S) + 2H20 (L) → Ca (OH) 2 (S) + C2H2 (G)
A teraz entalpie reagencií, produktov a reakcií:
- Reagencie: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
- Produkty: -986,0 kj/mol + 227,0 kJ/mol = -759 kJ/mol
Môže vám slúžiť: Čo sú to vektory Coplanares? (S vyriešenými cvičeniami)- Reakcia: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Je to exotermická reakcia.
-Cvičenie 2
Keď 1 liter acetylénu horí v štandardných podmienkach, koľko tepla sa oddeľuje?
Riešenie
Spaľovacia reakcia acetylénu po vyvážení je taká:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Potrebujeme entalpie produktového tréningu:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Výpočet entalpií
S týmito údajmi môžeme vypočítať entalpiu produktov:
ΔH ° (produkty) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
A Entalpia formácie činidla:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Entalpia reagencií bude:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
Entalpia molárnej reakcie bude potom: ΔH ° (produkty) - AH ° (reagencie) = -1072,8KJ/mol - 227,0 kJ/mol = -1299,8 kJ/mol
Entalpia spaľovania
Teraz potrebujeme vedieť, koľko mólov acetylénu je liter acetylénu v štandardných podmienkach. Z tohto.
Počet mólov n = p*v/(r*t)
P = 1 atm = 1,013 x 10⁵ pa
V = 1 l = 1,0 x 10^-3 m³
R = 8,31 j/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
Entalpia spaľovania 1 litra acetylénu je 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Negatívny znak naznačuje, že ide o exotermickú reakciu, ktorá vydáva 53,13 kJ = 12,69 kcal.
Odkazy
- Castaños e. Entalpia v chemických reakciách. Získané z: Lidiaconlachimica.Slovník.com
- Termochémia. Reakcia. Zdroj: Zdroje.vzdelávanie.je
- Termochémia. Definícia štandardnej reakčnej entalpie. Obnovené z: Quimitube.com
- Wikipedia. Entalpia štandardnej reakcie. Získané z: Wikipedia.com
- Wikipedia. Výcvik. Získané z: Wikipedia.com

