Štruktúra enolázy, mechanizmus pôsobenia, funkcie
- 5100
- 872
- Valentín Dula
Ten Enoláza Je to enzým zodpovedný za vykonávanie premeny d-2-fosfoglycelera (2pga) vo fosfoenolpyruváte (PEP) pri glykolýze a spätnej reakcie v glukoneogenéze, dve metabolické cesty, ktoré sú súčasťou metabolizmu bunkovej energie.
Rozhodnutie katalyzovať túto reakciu jedným alebo iným smerom závisí od prístupu, ktorý má bunka k glukóze. To znamená, že potreby prispôsobenia vášho metabolizmu degradácii alebo syntéze, aby sa získala energia. Nevyhnutné pre realizáciu svojich životne dôležitých procesov.
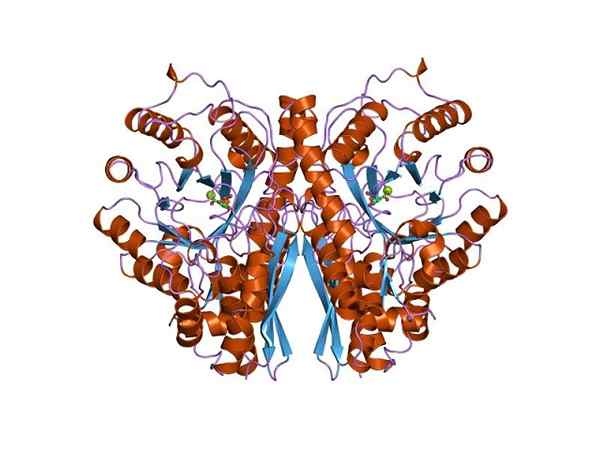
 Tri dimenzionálna štruktúra enolasy. Autor: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména (https: // creativecommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons.
Tri dimenzionálna štruktúra enolasy. Autor: Jawahar Swaminathan a personál MSD v Európskom bioinformatickom inštitúte [verejná doména (https: // creativecommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons. Pretože obe metabolické trasy patria do centra centrálneho metabolického stromu živých bytostí, nie je zvláštne, že aminokyselinová sekvencia tohto proteínu je zachovaná v archeae, baktériách a eukaryotoch. A preto, ktoré predstavujú podobné katalytické vlastnosti.
Poloha enolázy v bunke je obmedzená na cytosol, kompartment, v ktorom sa vo väčšine organizmov odohráva glykolýza (tiež nazývaná glykolýza) a glukoneogenéza vo väčšine organizmov.
Bol však detegovaný aj v iných bunkových kompartmentoch, ako je plazmatická membrána mnohých rakovinových buniek a buniek. Zdá sa, že sa podieľa na uľahčovaní procesov šírenia buniek, čo je úplne iná funkcia ako jej klasická funkcia.
Enzýmy schopné vykonávať viac ako jednu funkciu, ako to robí enolas, sú známe ako enzýmy na mesačnom osvetlení.
[TOC]
Štruktúra
Kvartérna štruktúra linus alebo nie v ligandoch bola stanovená u veľkého počtu prokaryotických a eukaryotických jedincov.
Každý monomér predstavuje dve domény: malá amino-terminálna doména a väčšia karboxylovo terminálna doména. N-terminálna doména sa skladá z troch a a štyroch β hárkov. Zatiaľ čo C-terminál pozostáva z ôsmich β hárkov, ktoré sa striedajú medzi nimi a tvoria β-barel, ktorý je obklopený ôsmimi a vrtuľami.
Okrem toho sa v každom monoméri nachádzajú dve miesta odborov pre dvojmocné katióny, ktoré sa nazývajú „konformačné miesto“ a „katalytické miesto“. Prvý nie je príliš selektívny a môže sa pripojiť k širokej škále dvojmocných katiónov v neprítomnosti substrátu.
Môže vám slúžiť: sfingolipidy: čo sú, charakteristiky, funkcie, syntézaZatiaľ čo sa druhý viaže na ióny po tom, čo sa substrát pripojil k enzýmu. Únia iónov na obidvoch lokalitách je nevyhnutné pre pokračovanie reakcie.
Nakoniec je dôležité spomenúť, že v homodiméroch sú monoméry spojené udržiavaním paralelnej orientácie. Preto je aktívne miesto obmedzené na ústredný región, ktorý tvorí uvedená únia.
Na katalýze sa však zúčastňuje iba jeden z týchto dvoch monomérov. To vysvetľuje, že schopnosť monomérov vykonávať reakciu v experimentálnych podmienkach.
Mechanizmus akcie
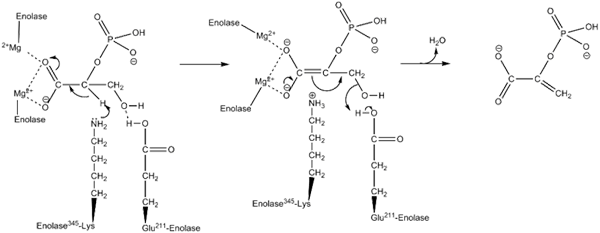 Mechanizmus účinku používaného enzýmom inolázy. Autor: Kthompson08 v angličtine Wikipedia [verejná doména (https: // creativecommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons.
Mechanizmus účinku používaného enzýmom inolázy. Autor: Kthompson08 v angličtine Wikipedia [verejná doména (https: // creativecommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons. Štrukturálne štúdie, ako aj tie, ktoré umožnili stanovenie kinetických a fyzikálno -chemických charakteristík enolasy, nám umožnili porozumieť ich mechanizmu pôsobenia.
Spôsob, akým enzým vykonáva katalýzu reakcie, je celkom zaujímavý. Aj keď ide o jediný substrát, navrhovaný je usporiadaný sekvenčný mechanizmus.
Začína sa tým spojením iónu Mg2+ na konformačné miesto jedného z monomérov. Nepretržitý s spojením substrátu na aktívne miesto, po ktorom nasleduje spojenie druhého iónu na katalytickom mieste a po vykonaní reakcie sa uzatvára rýchlym uvoľňovaním produktu. V tomto bode zostáva MG2+ spojený s konformačným miestom.
V rovnakom riadku, aby sa zvýraznila realizácia reakcie, priemerný enzým v prvom rade generovanie sprostredkovateľa Carbaniona, ktorý eliminuje protón uhlíka 2 2pga. To tak robí vďaka pôsobeniu základného zvyšku aminokyselín.
Odstránenie hydroxylu uhlíka 3 sa uskutočňuje pôsobením kyslého zvyšku z enzýmu. V tomto okamihu sa zväzok oboch uhlíkov vykonáva pomocou dvojitého spojenia s tvorbou Pep. Týmto spôsobom je reakcia vyvrcholená.
Môže vám slúžiť: Monera Kingdom: Charakteristiky, klasifikácia a príkladyFunkcia
Mnoho doteraz študovaných enzýmov je schopných vykonávať širokú škálu funkcií, ktoré nesúvisia s ich „klasickou funkciou“ v rôznych bunkových kompartmentoch. Tieto enzýmy sa nazývajú enzýmy „mesačným osvetlením“.
V tomto zmysle možno enolasy považovať za enzýmové mesačné svetlo, pretože v baktériách aj eukaryotoch sa k ich klasickej funkcii pripisovalo množstvo funkcií proti ich klasickej funkcii.
Niektoré z týchto funkcií sú nasledujúce:
- Zúčastnite sa na udržiavaní bunkovej formy, ako aj na vezikulárnej prevádzke pri interakcii s cytoskeletovými proteínmi.
- V jadre cicavcových buniek pôsobí ako transkripčný faktor, ktorý reguluje expresiu génov spojených s proliferáciou buniek. Spolupracovať pri udržiavaní stability RNM v degradácii baktérií.
- V patogénoch, ako napríklad Pneumónia streptococcus a Trypanosoma cruzi, Zdá sa, že pôsobí ako dôležitý faktor virulencie.
- Tiež sa zistilo, že v Pyogenes Streptococcus, Enoláza je vylúčená do extracelulárneho média uľahčujúceho degradáciu tkaniva a únik hostiteľského systému.
- Na povrchu nádorových buniek je exprimovaný zvýšením metastáz.
Enolas a jej vzťah k mechanizmom šírenia buniek
Početné patogény, ako aj nádorové bunky, exprimujú v ich membráne alebo vylučujte extracelulárne médiá, ktoré sú schopné degradovať proteínové proteíny.
Táto kapacita umožňuje týmto bunkám prelomiť tkanivá a rýchlo sa šíriť v celom hostiteľskom organizme. Tým sa uprednostňuje únik imunitného systému, a teda aj založenie infekcie.
Aj keď Enolasa nemá proteázovú aktivitu, zúčastňuje sa procesu šírenia mnohých patogénov v jeho hostiteľovi, ako aj v nádorových bunkách počas cieľa.
To ho dosahuje vďaka skutočnosti, že je exprimovaný na povrchu týchto buniek fungujúcich ako receptor plazminogénu. Posledne menovaný je zimogén sérínovej prototeázy známeho ako plazminát, ktorá je súčasťou fibrinolytického systému a pôsobí degradujúca extracelulárna matrica proteínov.
Preto je enoláza exprimovaná na povrchu stratégiou, ktorú tieto bunky získali na stanovenie infekcie a úspešnej šírenia.
Môže vám slúžiť: Sympatrická špekulácia: Koncept, charakteristiky a príkladyTáto stratégia pozostáva z dvoch procesov:
- Únik imunitného systému hostiteľa. Pretože, keď sú tieto bunky z hostiteľského proteínu potiahnuté, ignorujú sa bunkami imunitného systému, ktoré rozpoznávajú patogény NOM, ktoré sú spojené s patogénmi.
- Po-aktickom šírení plazminogénu v plazmináte. Ktorého účasť na degradácii proteínov extracelulárnej matrice, potom uľahčuje rýchle a účinné šírenie.
Odkazy
- Avilan L, Gualdron-Lopez M, Quiñones W, González-González L, Hannaert V, Michels Paa, Concepción JL. Enolase: kľúčový hráč v metabolizme a pravdepodobný virulenčný faktor trypanosomatidových parazitových perspektív pre jeho použitie ako terapeutický cieľ. Výskum. 2011 zv. Článok ID932549, 14 strán.
- Bhowmick I, Kumar N, Sharma S, Coppens I, Jarori GK, Plasmodium falciparum ennosoázy: štádia špecifická expresia a sub-cululárna lokalizácia. Denník malárie. 2009; 8 (1). Článok 179.
- Deň I, Peshavaria M, Quinn GB, diferenciálne molekulárne hodiny v evolúcii izoproteínu enoázy. Journal of Molecular Evolution. 1993; 36 (6): 599-601.
- Torre-Scuder E, Manzano-Román R, Pérez-Sánchez R, Silles-Lucas M, Oleaga A. Klonovanie a charakterizácia enolaázy z povrchu viažuce na plazminogén Bovis schistosoma. Veterinárna parazitológia. 2010; 173: 73-84.
- Dinovo EC, Boyer PD. Izotopové sondy mechanizmu reakcie enolázy. Počiatočné výmenné kurzy izotopov a rovnomerného izotopu: primárne a sekundárne účinky izotopov. J Biol Chem. 1971; 246 (14): 4586-4593.
- Kaberdin VR, Lin-Chao S, rozpad nových úloh pre menšie komponenty E. Coli RNA degraduál. Biológia RNA. 2009; 6 (4): 402-405.
- Keller A, Peltzer J, Carpentier G. Interakcie enolov. Biochimica et Biophysica Acta. 2007; 1770 (6): 919-926.
- Lung J, Liu KJ, Chang JY, Leu SJ, Shih NY. MBP-1 je účinne kódovaný alternatívnym transkriptom génového génu ENRI1 regulovaný proteínovým posunom závislým od proteazómu. Febs Journal. 2010; 277 (20): 4308-4321.
- Pancholi v. Multifunkčná a-enoláza: jej úloha pri chorobách. Bunkové a molekulárne životné vedy. 2001; 58 (7): 902-920.
- Poyner RR, Cleland WW, Reed GH. Úloha kovových INS pri katalýze pomocou enolázy. Usporiadaný kinetický mechanizmus pre jeden enzým substrátu. Biochémia. 2001; 40: 9008-8017.
- Segovia-Gamboa NC, Chávez-Munguía B, Medina-Flores A, Entamoeba napadá, Proces encystácie a enolase. Experimentálna parazitológia. 2010; 125 (2): 63-69.
- Tanaka M, Sugisaki K, Nakashima K, prepínanie hladín translatibilných mRNA pre enoázové izozýmy počas vývoja Chickn Ceast Sval sval. Biochemická a biofyzikálna výskumná komunikácia. 1985; 133 (3): 868-872.

