Charakteristiky iónového spojenia, ako formy a príklady

- 3111
- 178
- Tomáš Klapka
On iónový odkaz Je to typ chemickej väzby, v ktorej existuje elektrostatická príťažlivosť medzi iónmi s opačným zaťažením. To znamená, že pozitívne načítaný ión tvorí spojenie s iónom negatívne načítaným a prenáša elektróny z jedného atómu do druhého.
Tento typ chemickej väzby sa vyskytuje, keď sa valenčné elektróny jedného atómu natrvalo prenesú na iný. Atóm, ktorý stráca elektróny, sa stáva katiónom (pozitívne načítané) a ten, kto získa elektróny, sa stáva aniónom (negatívne načítané).
 Príklad iónovej väzby: Fluorid sodný. Sodík stráca elektrón Valencia a dáva ho fluoridu. WDCF [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Príklad iónovej väzby: Fluorid sodný. Sodík stráca elektrón Valencia a dáva ho fluoridu. WDCF [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)] [TOC]
Koncept iónového odkazu
Iónová väzba je taká. Toto spojenie je produktom elektrostatických interakcií medzi stovkami miliónov iónov a nie je obmedzené iba na pár z nich; to znamená, že ide nad rámec príťažlivosti medzi pozitívnym bremenom k negatívnemu zaťaženiu.
Zoberme si napríklad chlorid sodného iónovej zlúčeniny, NaCl, najlepšie ako stolová soľ. V NaCl prevažuje iónová väzba, takže sa skladá z NA iónov+ a cl-. Potom+ Je to pozitívny ión alebo katión, zatiaľ čo CL- (Chlorid) je negatívny ión alebo anión.
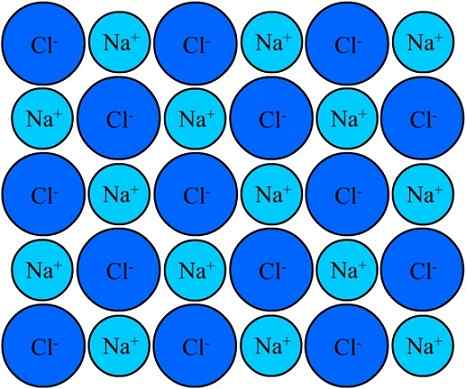 Na+ a ióny chloridu sodného zostávajú zjednotené vďaka iónovej väzbe. Zdroj: Eyal Bairey cez Wikipedia.
Na+ a ióny chloridu sodného zostávajú zjednotené vďaka iónovej väzbe. Zdroj: Eyal Bairey cez Wikipedia. Obidve na+ Ako cl- Priťahujú sa, že sú oproti elektrickým nábojom. Vzdialenosti medzi týmito iónmi umožňujú ostatným priblížiť sa, aby sa objavili páry a páry NaCl a páry. Katión+ Budú sa navzájom odraziť, aby boli rovnaké zaťaženie, a to isté sa stáva navzájom s CL aniónmi-.
Prichádza čas, keď milióny na ióny+ a cl- Podarí sa im zjednotiť, kohézne, aby vznikli čo najstabilnejšia štruktúra; Riadený iónovým odkazom (vynikajúci obraz). Katión+ Sú menšie ako CL anióny- Z dôvodu rastúcej účinnej jadrovej sily jeho jadra na vonkajších elektrónov.
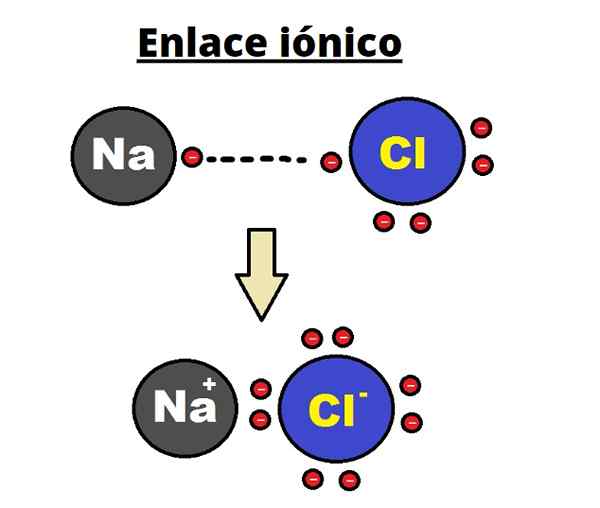 Iónový odkaz na NaCl. Rhannos/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Iónový odkaz na NaCl. Rhannos/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Iónová väzba sa vyznačuje stanovením usporiadaných štruktúr, kde je vzdialenosť medzi iónmi (NA+ a cl- V prípade NaCl) je malý v porovnaní s prípadom iných tuhých látok. Hovorí sa o iónovej kryštalickej štruktúre.
Ako je na tom iónový odkaz?
Iónová väzba sa uskutočňuje iba vtedy, ak dôjde k distribúcii elektrónov, aby vznikli zaťaženia iónov. Tento typ spojenia sa nikdy nemôže vyskytnúť medzi neutrálnymi časticami. Musí to nevyhnutne existovať katióny a anióny. Ale odkiaľ pochádzajú?
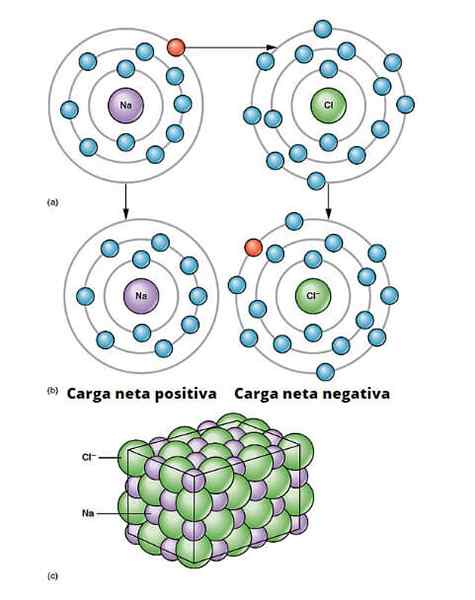 Ilustrácia iónového odkazu. a) Sodík má záporné čisté zaťaženie. b) Sodík poskytuje elektrón chlóru. Sodík je s pozitívnou čistou zaťažením a chlórom s záporným čistým zaťažením, ktoré vytvára iónovú väzbu. Tento typ prepojenia medzi miliónmi atómov Na a CL vedie k fyzickej soli. OpenX College/CC od (https: // creativeCommons.Org/licencie/o/3.0)
Ilustrácia iónového odkazu. a) Sodík má záporné čisté zaťaženie. b) Sodík poskytuje elektrón chlóru. Sodík je s pozitívnou čistou zaťažením a chlórom s záporným čistým zaťažením, ktoré vytvára iónovú väzbu. Tento typ prepojenia medzi miliónmi atómov Na a CL vedie k fyzickej soli. OpenX College/CC od (https: // creativeCommons.Org/licencie/o/3.0) Existuje mnoho spôsobov, pre ako pochádzajú ióny, ale v podstate mnohé sú založené na reakcii oxidačnej redukcie. Väčšina anorganických iónových zlúčenín pozostáva z kovového prvku s nemetalickým prvkom (v bloku p periodickej tabuľky).
Kov musí oxidovať, stratiť elektróny, aby sa transformoval na katión. Na druhej strane, nemetalický prvok je znížený, získava tieto elektróny a stáva sa aniónom. Nasledujúci obrázok ilustruje tento bod na tvorbu NaCl z atómov sodíka a chlóru:
Môže vám slúžiť: Kyselina arzén (H3SO4): Vlastnosti, riziká a použitia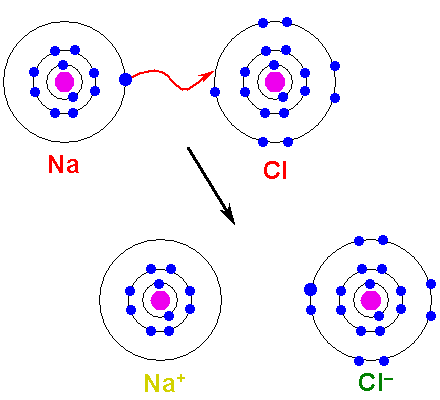 Tvorba iónového spojenia. Zdroj: Shafei v Arabic Wikipedia / Public Domain
Tvorba iónového spojenia. Zdroj: Shafei v Arabic Wikipedia / Public Domain Atom NA daruje jeden z jeho elektrónov vo Valencii CL. Ak dôjde k tomuto distribúcii elektrónov, vytvárajú sa ióny NA+ a cl-, ktoré začnú priťahovať okamžite a elektrostaticky.
Preto sa hovorí, že NA+ a cl- Nezdieľajú žiaden pár elektrónov, na rozdiel od toho, čo by sa dalo očakávať pre hypotetickú kovalentnú väzbu Na-Cl.
Vlastnosti iónového odkazu
Iónová väzba je nesmerná, to znamená, že jeho sila nie je prítomná jedným smerom, ale je šírená vesmírom na základe vzdialeností, ktoré oddeľujú ióny. Táto skutočnosť je dôležitá, pretože to znamená, že ióny sú silne zjednotené, čo vysvetľuje niekoľko fyzikálnych vlastností iónových tuhých látok.
Bod topenia
Iónová väzba je zodpovedná za soľ na teplotu 801 ° C. Táto teplota je značne vysoká v porovnaní s fúznymi bodmi niekoľkých kovov.
Je to preto, že NaCl musí absorbovať dostatok tepla, aby jeho ióny začali voľne prúdiť mimo svojich kryštálov; to znamená, že atrakcie medzi NA musia byť prekonané+ a cl-.
Bod varu
Body fúzie a varu iónových zlúčenín sú obzvlášť vysokým produktom ich silných elektrostatických interakcií: ich iónová väzba. Keďže však toto spojenie zahŕňa mnoho iónov, toto správanie sa zvyčajne udeľuje intermolekulárnym silám a nie správne na iónovú väzbu.
V prípade soli sa po roztopení NaCl, kvapalina zložená z rovnakých počiatočných iónov; Až teraz sa pohybujú s väčšou slobodou. Iónový odkaz je stále prítomný. Ióny+ a cl- Stretávajú sa na povrchu kvapaliny, aby vytvorili veľké povrchové napätie, ktoré zabraňuje úniku iónov v plynnej fáze.
Preto musí roztavená soľ ďalej zvýšiť svoju teplotu, aby sa uvarila. Bod varu NaCl je 1465 ° C. Pri tejto teplote teplo presahuje atrakcie medzi Na+ a cl- V kvapaline sa začnú tvoriť pary NaCl s tlakom rovnajúcim sa atmosférickým.
Elektronegativita
Predtým sa hovorilo, že iónová väzba sa vytvára medzi kovovým prvkom a nemetalickým prvkom. Súhrnné účty: medzi kovom a non -metal. Zvyčajne sa to týka anorganických iónových zlúčenín; Predovšetkým binárny typ, napríklad NaCl.
Pre distribúciu elektrónov (NA+Cl-) a nie zdieľanie (NA-Cl), musí existovať veľký rozdiel v elektronickejpativite medzi oboma atómami. Inak by medzi nimi neexistovala žiadne iónové spojenie. Možno prístup NA a CL, interaguje, ale okamžite CL, pre svoju väčšiu elektronegativitu „vytrhne elektrón na Na.
Tento scenár sa však uplatňuje iba na binárne zlúčeniny, MX, napríklad NaCl. V prípade iných soli alebo iónových zlúčenín sú ich výcvikové procesy komplikovanejšie a nemožno sa riešiť iba z atómového alebo molekulárneho hľadiska.
Môže vám slúžiť: AlquinosChlapci
Neexistujú žiadne rôzne typy iónových väzieb, pretože elektrostatický jav je čisto fyzický, mení sa iba spôsob, akým ióny interagujú, alebo počet atómov, ktoré majú; to znamená, že ak sú monoatomické alebo polyiatomické ióny. Každý prvok alebo zlúčenina tiež spôsobuje charakteristický ión, ktorý definuje povahu zlúčeniny.
V časti Príklady sa tento bod prehĺbi a bude zrejmé, že iónové spojenie je v podstate vo všetkých zlúčeninách rovnaké. Ak to nie je splnené, hovorí sa, že iónové puto má určitý kovalentný charakter, ktorý je v prípade mnohých prechodných kovov, kde sú anióny koordinované s katiónmi; Napríklad fecl3 (Viera3+-Cl-).
Príklady iónových odkazov
Nižšie bude uvedených niekoľko iónových zlúčenín a ich ióny a proporcie sa zvýraznia:
- Chlorid horečnatého
Mgcl2, (Mg2+Cl-), V pomere 1: 2 (mg2+: 2 Cl-)
- Fluorid draslíka
Kf, (k+F-), V pomere 1: 1 (k+: F-)
- Sulfid sodný
Nat2S, (na+Siež2-), V pomere 2: 1 (2+: S2-)
- Lito hydroxid
Lioh, (li+Oh-), V pomere 1: 1 (li+: Oh-)
- Fluorid vápenatý
Kaviareň2, (AC2+F-), V pomere 1: 2 (CA2+: 2f-)
- Uhličitan sodný
Nat2Co3, (Na+Co32-), V pomere 2: 1 (2+: Co32-)
- Uhličitan vápenatý
Zlodej3, (AC2+Co32-), V pomere 1: 1 (CA2+: Co32-)
- Manganistan draselný
Kmno4, (K+Nadnášať4-), V pomere 1: 1 (k+: MN4-)
- Sulfát medi
Cuso4, (Cu2+SW42-), V podiele 1: 1 (cu2+: Tak42-)
- Hydroxid bária
Ba (oh)2, (BA2+Oh-), V pomere 1: 2 (BA2+: Oh-)
- Hliníkový bromid
Alb3, (3+Br-), v podiele 1: 3 (k3+: 3br-)
- Oxid železa (III)
Vernosť2Ani3, (Viera3+Ani2-), V pomere 2: 3 (2FE3+: 32-)
- Oxid stroncia
SRO, (SR2+Ani2-), V pomere 1: 1 (SR2+: Buď2-)
- Chlorid striebra
AGCL, (AG+Cl-), V podiele 1: 1 (AG+: Cl-)
- Ďalší
-Chvály3Cona, (vyberte si3Coo-Nat+), V podiele 1: 1 (cho3Coo-: Na+)
- NH4I, (NH4+Jo-), V pomere 1: 1 (NH4+: Jo-)
Každá z týchto zlúčenín predstavuje iónovú väzbu, kde milióny iónov, ktoré zodpovedajú ich chemickým vzorcom, priťahujú elektrostaticky a pochádzajú z pevnej látky. Čím väčšia je veľkosť jeho iónového zaťaženia, tým intenzívnejšie sú atrakcie a elektrostatické odporu.
Preto má iónová väzba tendenciu byť silnejšia, čím väčšie sú náskoky iónov, ktoré tvoria zlúčeninu.
Môže vám slúžiť: AlkényVyriešené cvičenia
Niektoré cvičenia, ktoré uvedú základné znalosti iónového spojenia, budú vyriešené nižšie.
- Cvičenie 1
Ktorá z nasledujúcich zlúčenín je iónová? Možnosti sú: HF, h2Alebo, nie, h2S, nh3 a mgo.
Iónová zlúčenina musí mať podľa definície iónovú väzbu. Čím väčší je rozdiel v elektronegativite medzi prvkami zložiek, tým väčší je iónový charakter uvedeného spojenia.
Preto sú možnosti, ktoré nemajú kovový prvok2Alebo h2S a nh3. Všetky tieto zlúčeniny sú tvorené iba nemetalickými prvkami. Katión NH4+ Je to výnimka z tohto pravidla, pretože nemá kov.
Zostávajúce možnosti sú NAH a MGO, ktoré majú kovy NA a MG, zjednotené s ne -metalickými prvkami. Nah (na+H-) a mgo (mg2+Ani2-) Sú to iónové zlúčeniny.
- Cvičenie 2
Zvážte nasledujúcu hypotetickú zlúčeninu: Ag (NH4)2Co3Jo. Aké sú vaše ióny a v akom pomere sú v tuhých?
Rozklad zlúčeniny na ich ióny, ktoré máme: AG+, NH4+, Co32- a ja-. Sú spojené elektrostaticky po podiele 1: 2: 1: 1 (AG+: 2nh4+: Co32-: Jo-). Znamená, že množstvo katiónov NH4+ Je to dvojnásobok, že pre ióny AG+, Co32- a ja-.
- Cvičenie 3
Ktorú z nasledujúcich zlúčenín by sa v zásade očakávalo, že najsilnejšie iónové spojenie malo? Možnosti sú: KBR, CAS, NA2SW4, Cuo, Alpo4 a pb3P4.
KBR sa skladá z K iónov+ a br-, S veľkosťou zaťaženia. Potom má CAS ióny CA2+ a s2-, Pri dvojitom veľkosti zaťaženia, takže sa dá predpokladať, že iónové spojenie v CAS je silnejšie ako v KBR; A tiež silnejšie ako v NA2SW4, pretože posledne menovaný je zložený z NA iónov+ A tak42-.
CAS aj CUO môžu mať rovnaké silné iónové spojenie, pretože obe obsahujú ióny s dvojitým zaťažením. Potom máme alpa4, s iónmi al3+ a po43-. Tieto ióny majú trojnásobné zaťaženie veľkosti, takže iónový odkaz v Alpo4 Malo by byť silnejšie ako vo všetkých vyššie uvedených možnostiach.
A nakoniec máme víťaza PB3P4, Ak predpokladáme, že je tvorený iónmi, stanú sa PB4+ A p3-. Ich zaťaženia majú najväčšie veľkosti; A preto PB3P4 Je to zlúčenina, ktorá má pravdepodobne najsilnejšiu iónovú väzbu.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Iónové spojenie. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Iónové verzus kovalentné väzby - porozumieť rozdielu. Zotavené z: Thoughtco.com
- Redaktori Enyclopaedia Britannica. (31. januára 2020). Iónová väzba. Encyclopædia Britannica. Získané z: Britannica.com
- Chemický slovník. (2017). Definícia iónového spojenia. Získané z: Chemicool.com
- « Granrataria vyvážené funkcie, diely a ako ich používať
- Rutherford History Atomic Model, experimenty, postuláty »

