Rutherford History Atomic Model, experimenty, postuláty
- 5093
- 1480
- Blažej Hrmo
On Rutherford Atomic Model Je to opis atómu vytvoreného britským fyzikom Ernestom Rutherfordom (1871-1937), keď v roku 1911 objavil atómové jadro, a to vďaka slávnym disperzným experimentom, ktoré sa pomenujú.
Myšlienka atómu (“nedeliteľný„V gréčtine) ako najmenšia súčasť hmoty to bola intelektuálna tvorba narodená v starovekom Grécku, okolo 300 až.C. Rovnako ako mnoho iných gréckych pojmov, aj koncept atómu je vyvinutý na základe logiky a argumentácie, ale nie na experimentovaní.
 Rutherford Atomic Model
Rutherford Atomic Model Najvýznamnejšími atomistickými filozofmi boli Demokritus Abdera (460 - 360 pred Kristom), epicurus Samos (341 - 270 AC) a Tito Lucrecio (98 - 54 AC). Gréci koncipovali štyri rôzne typy atómov, ktoré zodpovedali štyrom prvkom, ktoré podľa nich tvorili záležitosť: vzduch, voda, zem a oheň.
Následne by Aristoteles pridal piaty prvok: éter, ktorý tvoril hviezdy, pretože ostatné štyri prvky boli čisto pozemské.
Dobytie Alexandra Veľkého, ktorého Aristoteles bol učiteľom, rozšíril svoje presvedčenie o starovekom svete, zo Španielska do Indie, a teda po stáročia myšlienka atóm Vytvoril svoje vlastné miesto vo svete vedy.
[TOC]
Atóm prestane byť nedeliteľný
Myšlienky gréckych filozofov o štruktúre predmetu boli udržiavané ako isté stovky rokov, až kým anglický chemik a učiteľ zvaný John Dalton (1776-1844) nezverejnil výsledky svojich experimentov v roku 1808.
Dalton súhlasil s tým, že prvky sú tvorené extrémne malými časticami, nazývané atómy. Ale išlo ďalej tvrdením, že všetky atómy toho istého prvku sú rovnaké, majú rovnakú veľkosť, rovnakú hmotnosť a rovnaké chemické vlastnosti, vďaka ktorým zostanú nezmenené počas chemickej reakcie.
Toto je prvý atómový model s vedeckou nadáciou. Rovnako ako Gréci, aj Dalton naďalej považoval atóm za nedeliteľný, a preto mu chýba štruktúra. Daltonov génius ho však priviedol k pozorovaniu jedného z veľkých princípov ochrany fyziky:
- V chemických reakciách, Atómy nie sú stvorené ani zničené, Menia iba svoju distribúciu.
A stanovili spôsob, akým boli chemické zlúčeniny tvorené „atómami zlúčenín“ (molekuly):
- Keď sa kombinujú dva alebo viac atómov rôznych prvkov, aby vytvorili rovnakú zlúčeninu, vždy to robia v hmotnostných pomeroch definované a konštantné.
19. storočie bolo veľkým storočím elektriny a magnetizmu. Niekoľko rokov po Daltonových publikáciách výsledky niektorých experimentov zasiali pochybnosti vedcov o nedeliteľnosti atómu.
Môže vám slúžiť: Aká je kapacitná reaktancia a ako ju vypočítať?Rúrka
Crookes Tube bola zariadenie navrhnuté britským chemikom a meteorológom Williamom Crookesom (1832-1919). Experiment, ktorý Crookes uskutočňoval v roku 1875, pozostával z umiestnenia do trubice plného plynu pri nízkom tlaku, dva elektródy, jeden nazývaný katóda a ďalší volá anóda.
Vytvorením potenciálneho rozdielu medzi obom. Táto skutočnosť naznačuje, že v rámci atómu existuje určitá konkrétna organizácia, a preto nebola nedeliteľná.
Okrem toho toto žiarenie spôsobilo slabú fluorescenciu v stene sklenenej trubice pred katódou, čím sa rezal tieň krížovej značky umiestnenej vo vnútri trubice.
Bolo to záhadné žiarenie známe ako „katódové lúče“, ktoré sa pohybovalo v priamej línii k anóde a ktoré bolo vysoko energické, schopné vytvárať mechanické účinky a ktoré sa odchýlili smerom k pozitívne zaťaženej doske alebo tiež magnetmi.
Objav elektrónu
Žiarenie vo vnútri krivých trubí. Joseph John Thomson (1856 - 1940) našiel odpoveď v roku 1887, keď našiel vzťah medzi zaťažením a hmotnosťou tohto žiarenia a zistil, že to bolo vždy rovnaké: 1,76 x 10jedenásť C/kg., Bez ohľadu na plyn uzamknutý v trubici alebo materiál použitý na výrobu katódy.
Thomson nazval tieto častice mŕtvy. Meraním jej hmoty vo vzťahu k jej elektrickému náboju dospel k záveru, že každý korpus je oveľa menší ako atóm. Preto navrhol, aby boli súčasťou ich súčasťou, a tak objavili elektrón.
Britský vedec bol prvým, kto načrtol grafický model atómu prostredníctvom kresby sféry vloženými bodmi, ktoré jej formou dostali označenie „Buddina z Ciruely“. Tento objav však priniesol ďalšie otázky:
- Ak je záležitosť neutrálna a elektrón má záporné zaťaženie: v ktorej časti atómu je kladné zaťaženie, ktoré neutralizuje elektróny?
- Ak je elektrónová hmota nižšia ako hmotnosť atómu, z čoho zvyšok atómu pozostáva?
- Prečo boli častice získané vždy elektróny a nikdy iného typu?
Experimenty s disperznými disperziami v Rutherforde: atómové jadro a protón
V roku 1898 Rutherford identifikoval dva typy žiarenia z uránu, ktoré nazval alfa a beta.
Prírodná rádioaktivita už objavila Marie Curie v roku 1896. Alfa častice majú pozitívne zaťaženie a sú jednoducho héliové jadrá, ale v tom čase nebol koncept jadra ešte známy. Rutherford sa to chystal objaviť.
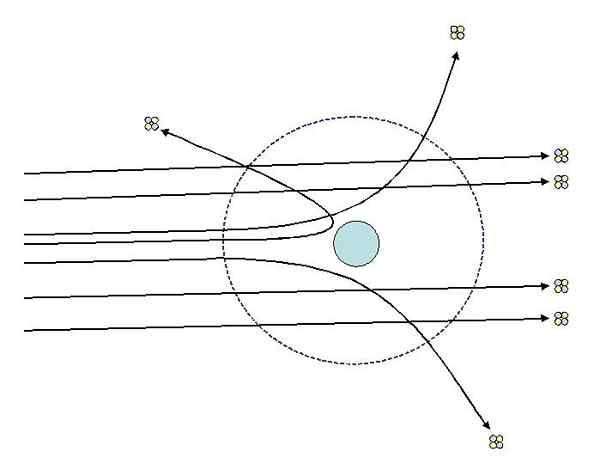
Môže vám slúžiť: termodynamický systém: vlastnosti, typy, príkladyJeden z experimentov, ktoré Rutherford uskutočnil v roku 1911 na Manchesterskej univerzite, s pomocou Hans Geiger, pozostával z bombardovania jemného zlata s časticami alfa, ktorého zaťaženie je pozitívne. Okolo zlatého plechu umiestnil fluorescenčnú obrazovku, ktorá im umožnila vizualizovať účinky bombardovania.
Pozorovanie
Štúdium vplyvu na fluorescenčnú obrazovku, Rutherford a jej asistenti to poznamenali:
- Vysoké percento alfa častíc prekročilo list bez výraznej odchýlky.
- Niektorí sa odchýlili v pomerne výrazných uhloch
- A veľmi málo odrazené dozadu
 Experimenty Rutherford Disperzia. Zdroj: [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]].
Experimenty Rutherford Disperzia. Zdroj: [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Pozorovania 2 a 3 prekvapili vyšetrovateľov a viedli ich k predpokladaniu, že osoba zodpovedná za rozptýlené lúče by mala mať kladný poplatok a že na základe pozorovania čísla 1 mala táto osoba zodpovedná oveľa menšia veľkosť ako v prípade alfa častíc.
Samotný Rutherford v tejto súvislosti povedal, že to bolo „... akoby ste vyskúšali 15 -palcový námorný projektil proti hárku papiera a projektil sa odrazil a zasiahol vás“. Toto by určite mohlo vysvetliť model Thompsona.
Rutherford, ktorý analyzoval svoje výsledky z klasického hľadiska.
Rutherford pokračoval vo svojich disperzných experimentoch. V roku 1918 boli novým cieľom alfa častíc atómy plynného dusíka.
Týmto spôsobom detegoval vodíkové jadrá a okamžite vedel, že jediné miesto, z ktorého tieto jadrá môžu pochádzať zo samotného dusíka. Ako bolo možné, že vodíkové jadrá boli súčasťou dusíka?
Rutherford potom navrhol, že vodíkové jadro, prvok, ktorému už bolo pridelené atómové číslo 1, by malo byť základnou časticou. Volám jej protón, Grécke slovo na označenie najprv. Objavy atómového jadra a protónu sú teda spôsobené týmto brilantným neozyreom.
Postuluje Rutherfordov atómový model
Nový model sa veľmi líšil od Thompsona. Boli to jeho postuláty:
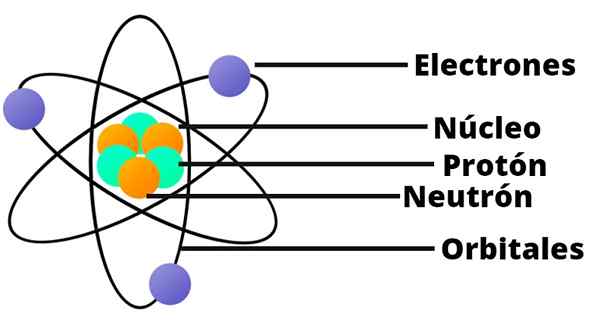
- Atom obsahuje pozitívne naložené jadro, ktoré napriek tomu, že je veľmi malý, obsahuje takmer celú hmotnosť atómu.
- Elektróny obiehajú atómové jadro vo veľkej vzdialenosti a v kruhových alebo eliptických dráhach.
- Čisté zaťaženie atómu je neplatné, pretože náboje elektrónov kompenzujú kladné zaťaženie prítomné v jadre.
Výpočty Rutherfordu poukázali na sférické jadro a rádio ako 10-pätnásť m, čo je hodnota atómového polomeru asi 100.000 krát vyššie, pretože jadrá sú od seba pomerne veľmi vzdialené: z poradia 10-10 m.
 Mladý Ernest Rutherford. Zdroj: Neznámy, publikovaný v roku 1939 v Rutherforde: Byť životom a písmenami RT. Hon. Lord Rutherford, alebo. M [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)]
Mladý Ernest Rutherford. Zdroj: Neznámy, publikovaný v roku 1939 v Rutherforde: Byť životom a písmenami RT. Hon. Lord Rutherford, alebo. M [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)] To vysvetľuje, prečo väčšina alfa častíc prekročila plachtu bez nepríjemností alebo sotva zažila veľmi malú deformáciu.
Pri každodenných objektoch by Rutherfordov atóm bol zložený z jadra veľkosti baseballu, zatiaľ čo atómový polomer by bol asi 8 km. Preto sa atóm dá považovať za takmer všetko za prázdny priestor.
Vďaka svojej podobnosti s miniatúrnou slnečnou sústavou bola známa ako „planetárny model atómu“. Elektrostatická príťažlivosť medzi jadrom a elektrónmi by bola analogická gravitačnej príťažlivosti medzi slnkom a planétami.
Obmedzenia
Vyskytli sa však určité nezhody týkajúce sa niektorých pozorovaných skutočností:
- Ak je akceptovaná myšlienka, že elektrónová obežná dráha okolo jadra je akceptovaná, stane sa, že elektrón by mal neustále vyžarovať žiarenie, až kým sa nezráža s jadrom, s následnou zničením atómu za oveľa menej ako sekundy. Toto, našťastie to nie je to, čo sa skutočne stáva.
- Okrem toho v určitých príležitostiach atóm emituje určité frekvencie elektromagnetického žiarenia, keď existujú prechody medzi stavom väčšej energie na jednu s menšou energiou a iba tie frekvencie, nie iné. Ako vysvetliť skutočnosť, že energia sa kvantifikuje?
Napriek týmto obmedzeniam a že dnes existujú oveľa sofistikovanejšie modely a podľa pozorovaných faktov je Rutherfordov atómový model stále užitočný pre študenta, aby mal prvý úspešný prístup k atómu a jeho zložitých častíc.
V tomto modeli atómu sa neutrón neobjaví, ďalšia zložka jadra, ktorá sa objavila až v roku 1932.
Krátko po tom, čo Rutherford navrhol svoj planetárny model, v roku 1913 by ho dánsky fyzik Niels Bohr upravil, aby vysvetlil, prečo nie je zničený atóm, a my sme stále tu, aby sme rozprávali tento príbeh.
Predmety záujmu
Schrödinger atómový model.
Broglie atómový model.
Atómový model Chadwick.
Heisenberg atómový model.
Perrin atómový model.
Thomson Atomic Model.
Atómový model Dirac Jordan.
Atómový model demokritu.
Bohr atómový model.
Atómový model Dalton.
Odkazy
- Rex, a. 2011. Základy fyziky. Pearson. 618-621.
- Zapata, f. 2007. Poznámky do triedy pre kreslo rádiobiológie a rádiologickej ochrany. Škola verejnej zdravotníctva Centrálnej univerzity vo Venezuele.

