Prvky, zlúčeniny a zmesi
- 4956
- 1017
- Valentín Dula
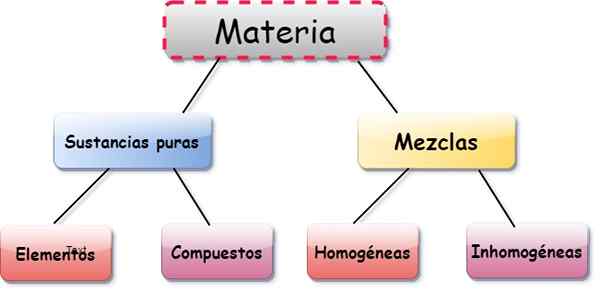
Prvky, zlúčeniny a zmesi sú tri formy prezentácie hmoty. Ten predmety Sú látkami tvorené jedinou triedou atómu, zloženia Sú to kombinácie medzi dvoma alebo viacerými prvkami a zmesi Vyplývajú z zloženia niekoľkých prvkov a látok.
Komponenty zmesí sú oddelené fyzickými prostriedkami. Pokiaľ ide o oddelenie prvkov zlúčeniny, musia sa vykonávať chemické postupy.
Neexistuje spôsob, ako ich rozdeliť na menšie komponenty pomocou bežných metód, ale existujú spôsoby, ako vypuknúť atómy. Štiepenie je v skutočnosti spôsob, ako z nich získať energiu.
Atómy, ktoré tvoria určitú zlúčeninu, tak vždy robia v pevných rozmeroch. Pokiaľ ide o svoju časť, v zmesi sa proporcie jeho komponentov môžu meniť. Preto sa prvky a zlúčeniny považujú za čisté látky, ktorých zloženie je konštantné a dobre definované.
Napríklad stolová soľ alebo chlorid sodný je zlúčenina, na ktorej sa zúčastňujú atómy chlóru a sodíka, v podiele jedného po druhom. Medzitým je mlieko zmes premenlivej kompozície, v ktorej si každá zložka zachováva svoju identitu.
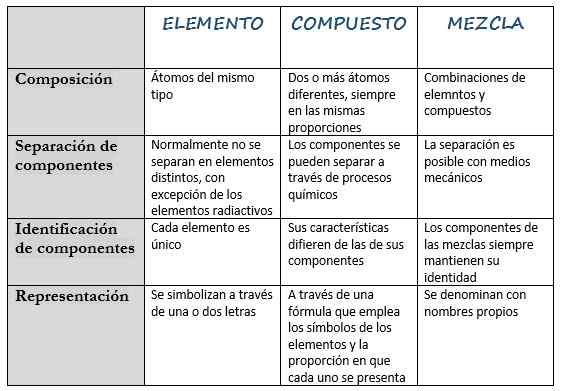
Nasledujúca tabuľka zhromažďuje svoje hlavné charakteristiky:
Element | Zmes | Zmiešať | |
Definícia | Látka, ktorú nemožno rozložiť v iných jednoduchších látkach. | Látka tvorená dvoma alebo viacerými rôznymi prvkami. | Látka vyrobená pri miešaní iných látok. |
Kompozícia | Atómy rovnakého typu. | Dva alebo viac rôznych atómov, vždy v rovnakých rozmeroch. | Kombinácie prvkov a zlúčenín. |
Oddelenie komponentov | Normálne sa neoddeľujú na rôzne prvky, s výnimkou rádioaktívnych prvkov. | Komponenty sa môžu oddeliť chemickými procesmi. | Oddelenie je možné pomocou mechanických prostriedkov. |
Identifikácia komponentov | Každý prvok je jedinečný. | Jeho charakteristiky sa líšia od charakteristík jej zložiek. | Komponenty zmesí vždy udržiavajú svoju identitu. |
Zastúpenie | Sú symbolizované jedným alebo dvoma písmenami. | Prostredníctvom vzorca, ktorý používa symboly prvkov a pomer, v ktorom je každý prezentovaný. | Volá sa s vlastnými menami. |
Príklady | Vodík (H), kremík (áno), hélium (HE), zlato (Au), draslík (k). | Chlorid sodný (NaCl), amoniak (NH3), hydrid sodný (NAH), oxid dusične (NO2). | Krv, mlieko, vzduch, cement. |
Predmety
Definícia
Prvky sú čisté, jednoduché látky, v ktorých zloženie iba atómy toho istého typu zasahujú. Chemické správanie každého prvku je charakteristické a neexistujú dva rovnaké, hoci medzi skupinami prvkov existujú spoločné vlastnosti.
Môže vám slúžiť: jodometria: základy, reakcie, všeobecný postup, použitieNie je možné rozkladať jeden prvok jednoduchším, s výnimkou osobitných postupov, ako je bombardovanie.
Proces dezintegrácie sa vyskytuje spontánne v niektorých látkach, ako sú rádio, určité odrody uránu, tória a ďalších prvkov nazývaných rádioaktívne.
Kompozícia
Prvky sú tvorené rovnakými atómami. Tieto sú zase zložené z troch druhov častíc: elektróny, protóny a neutróny. Elektróny a protóny majú elektrickú, negatívnu a pozitívnu hmotu. Neutróny majú hmotnosť, ale nie načítanie.
Atóm pozostáva z atómového jadra vytvoreného protónmi a neutrónmi, zatiaľ čo elektróny sú distribuované na orbitáloch okolo nich. Jeden prvok sa od iného odlišuje počtom protónov, ktoré jeho jadro nazýva atómové číslo.
Aj keď to zostáva konštantné, je to rovnaký prvok, aj keď sa počet neutrónov a elektrónov zmení, pretože v takom prípade izotopy.
Identifikácia komponentov
Používajú sa rôzne a komplexné techniky, napríklad na „vidieť“ elektróny atómu, existujú špeciálne mikroskopy, ako je napríklad mikroskopový efekt tunela.
Technika separácie
Atóm prvku nie je oddelený chemickými metódami, ale je bombardovaný menšími časticami, zvyčajne neutrónmi, v procese nazývanom jadrové štiepenie. Ale aj keď teoreticky je každý atóm fyzicky, je ľahšie urobiť to s atómami, ktoré majú ťažké jadrá, ako je urán-235.
Typy prvkov
V periodickej tabuľke sa nachádza 118 prvkov, usporiadaných podľa atómového čísla. Z toho 92 sa nachádza v prírode a zostávajúce sa získavajú v laboratóriu.
Môže vám slúžiť: Amorfný uhlík: Čo je, typy, vlastnosti, použitieSú distribuované v troch skupinách:
- Kovy s voľnými elektrónmi, vďaka ktorým sú dobré vodiče tepla a elektriny, takmer vždy pevné (okrem ortuti) a vysokou hustotou.
- Žiadne kovy, vlastnosti chýbajúceho správania, nie sú prezentované v pevnom alebo plynnom stave, okrem brómu, a ich hustota je nižšia.
- Metaloidy, prvky s strednými charakteristikami medzi kovmi a nemetami.
Grafická reprezentácia
Každý prvok periodickej tabuľky je symbolizovaný písmenami. Napríklad H, O, C a Fe zodpovedajú vodíku, kyslíku, uhlíku a železa.
Príklady prvkov
Okrem spomenutých, existujú nasledujúce prvky s ich symbolom v zátvorkách:
- Chlór (CL)
- Ortuť (HG)
- Fosfor (p)
- Jód (i)
- Horčík (mg)
Zloženia
Definícia
Zlúčeniny sú čisté látky, ktorých zloženie sú v určitých rozmeroch zapojené dva alebo viac typov rôznych atómov za vzniku molekúl. Odbory medzi atómami sa vykonávajú odkazmi, ktoré sú určujúcim faktorom v zložených vlastnostiach.
Hlavné odkazy sú:
- Iónový
- Kov
- Kovalentný
Kompozícia
Zlúčeniny pozostávajú z dvoch alebo viacerých typov atómov, vždy v pevnom pomere.
Identifikácia komponentov
Každá zlúčenina má vlastnosti, vďaka ktorým je jedinečná, ktoré sa líšia od vlastností svojich prvkov zložiek, pretože strácajú svoju identitu vytvorením zlúčeniny. Napríklad pri teplote miestnosti vodík a kyslík sú plyny, ktoré pri kombinovaní vedú k vode.
Technika separácie
Normálne sa zlúčeniny oddeľujú chemickými reakciami, hoci elektromagnetické žiarenie vrátane svetla je tiež schopné disociovať molekuly.
Typy zlúčenín
Zlúčeniny sú rozdelené do dvoch hlavných kategórií:
- Anorganický
- Organický
Rozdiel je v tom, že organické zlúčeniny sú založené na uhlíkovom prvku, keď tvorí kovalentné väzby s vodíkom. Uhlík sa podieľa rovnakým spôsobom v mnohých anorganických zlúčeninách, čím sa vytvára ďalšie spojenia.
Grafická reprezentácia
Robí sa prostredníctvom jeho chemického vzorca, v ktorom sú špecifikované jeho zložky, s ich príslušným symbolom a podielom, na ktorom sa zúčastňujú. Zlúčeniny majú tiež rôzne názvy.
Príklady zlúčenín
- Chlorid sodný alebo stolová soľ (NaCl)
- Hydrogenuhličitan sodný (NAHCO₃)
- Amoniak (NH3)
- Uhličitan vápenatý (Caco3)
- Glukóza (c₆h₁₂o₆)
Zmesi
Definícia
Kombinácia dvoch alebo viacerých prvkov a/alebo zlúčenín, bez definovaných proporcií, z ktorých každá udržiava svoju identitu, to znamená bez toho, aby sa ich vlastnosti zmenili, keď sú súčasťou zmesi.
Kompozícia
Je to variabilné.
Identifikácia komponentov
Je jednoduchšie vykonávať, pretože komponenty si zachovávajú svoju identitu.
Technika separácie
Komponenty zmesi sa môžu separovať nejakou fyzikálnou alebo mechanickou metódou, napríklad filtrovanie alebo odstredenie.
Typy zmesí
Zmesi sú klasifikované ako:
- Homogénne: Častice zložiek sú nerozoznateľné, napriek tomu, že sú rôznymi látkami. Napríklad veľmi rozpustený cukor vo vode.
- Heterogénne: zmesi, v ktorých sa častice rozlišujú, dokonca aj voľným okom, ako je piesok a soľ alebo soľ zmiešané s kovovými súbormi.
Grafická reprezentácia
Zmesi nemajú definovaný vzorec, ale mnohí majú svoje vlastné mená.
Príklady zmesí
- Cement
- Kečup
- Drevo
- Vysielať
- Mlieko
- Betón
- Krv

