Silný koncept elektrolytov, charakteristiky, príklady

- 2121
- 572
- Denis Škriniar
A Silný elektrolyt Je to všetko, čo je látka rozpustená vo vode alebo v špecifickom rozpúšťadle, je úplne disociovaná na iónoch. Preto by nemal existovať roztok ako neutrálne molekuly alebo ako nerozpustné tuhé látky. Silným elektrolytom môže byť soľ, kyselina alebo báza za predpokladu, že disociujú alebo úplne iónové.
Najreprezentatívnejším príkladom elektrolytu je bežná soľ, chlorid sodný, NaCl. Vo vodnom roztoku sa kryštály NaCl oddeľujú v celom svete, aby sa vytvorili ióny+ a cl-, To skončí okolitými molekulami vody. Potom sa hovorí, že soľ sa správa ako silný elektrolyt, keď je jeho rozpustnosť veľmi vysoká voda.
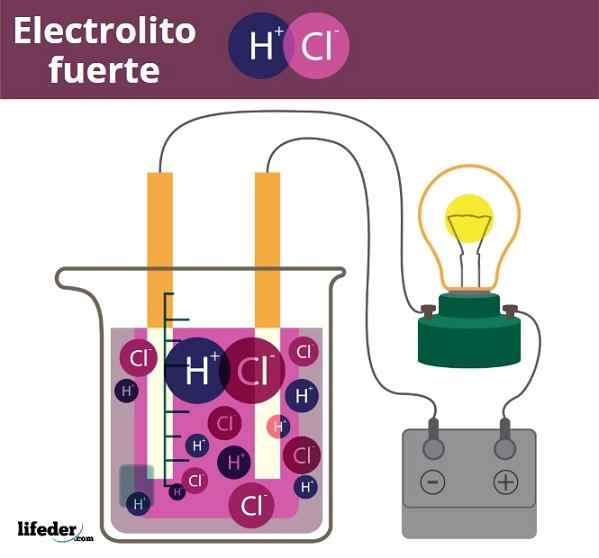 Fuero elektrolite príklad. HCl, kyselina chlorovodíková, uvoľňujte ióny H3O+ a CL-
Fuero elektrolite príklad. HCl, kyselina chlorovodíková, uvoľňujte ióny H3O+ a CL- Trochu podobný je prípad kyselín a základov. Ak sú silné, ich roztoky vo vode produkujú maximálne možné množstvo H iónov3Ani+ alebo oh-, Takže zmeny pH sú náhle. Príkladmi silných kyselín a báz sú kyselina dusičná, HNO3, a hydroxid draselný, KOH, respektíve.
Je dôležité vedieť, ako identifikovať silné elektrolyty pri príprave veľmi iónových roztokov alebo veľmi silných kyselín alebo základných prostriedkov.
[TOC]
Charakteristiky silných elektrolytov
Rozpustnosť
Silné elektrolyty sa vyznačujú tým, že sú mimoriadne rozpustné vodné látky. Či už tuhá látka alebo plyny, pri príchode do kontaktu s vodou, nemalo by sa príliš odložiť. Ak je napríklad soľ málo rozpustná vo vode, môže byť vyradená ako silný elektrolyt.
Iónová vodivosť
Silné elektrolyty sú nielen veľmi rozpustné vo vode, ale tiež vytvárajú veľké množstvo iónov. Vďaka elektrickým poplatkom týchto iónov môžu elektróny pohodlne cestovať po riešeniach. To sa odráža vo zvýšení iónovej vodivosti vzhľadom na čistú vodu. Preto iónové roztoky vedú veľmi dobre elektrinu.
Môže vám slúžiť: chlór: História, vlastnosti, štruktúra, riziká, použitiaNeutralita soľného roztoku
Mnoho silných elektrolytov so fyziologickým roztokom, keď sa rozpúšťajú vo vode, neprodukujú žiadne zmeny pH. To znamená, že roztoky týchto solí nie sú kyslé alebo základné, ale neutrálne, s pH takmer 7.
Môžu však existovať kyslé alebo základné soli, ktoré sa ľahko rozpustia vo vode a ktoré tiež vytvárajú úplné ióny. Napríklad uhličitan sodný2Co3, rozpúšťa sa, aby generoval ióny+ a co32-, Ale pH riešenia je základné.
Príklady silných elektrolytov
 Chlorid sodný je najreprezentatívnejším príkladom silného elektrolytu. Zdroj: Cristian V. /Cc By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)
Chlorid sodný je najreprezentatívnejším príkladom silného elektrolytu. Zdroj: Cristian V. /Cc By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0) Silné elektrolyty, ktoré sú toľko, sú rozdelené do troch klasifikácií: silné kyseliny, silné bázy a rozpustné solí produkt neutralizácie medzi prvými dvoma.
Silné kyseliny
Silné kyseliny, keď sa rozpúšťajú vo vode, bez problémov, musia produkovať maximálne možné množstvo H3Ani+, Kyselina musí byť teda úplne ión; to znamená, že by nemala existovať ako neutrálna molekula s kyslými protónmi bez uvoľnenia.
Príklady týchto kyselín sú:
-HCl, kyselina chlorovodíková, uvoľňuje H ióny3Ani+ a cl-
-HF, kyselina fluórska, uvoľňuje H ióny3Ani+ a f-
-Hned3, Kyselina dusičná, uvoľnite hones h3Ani+ a nie3-
-HCLO4, Kyselina percrórová, uvoľňuje H ióny3Ani+ a clo4-
-Hio4, Kyselina periódová, uvoľňuje h -ióny3Ani+ a io4-
-H2SW4, kyselina sírová, uvoľnite hones h3Ani+ A tak42-
Dôvod, prečo hydrium ión, h3Ani+, Je vždy prítomný (tak či onak), je to preto, že vodík, ktorý darujú, je prijatá molekulami vody:
HCl + H2O → h3Ani+ + Cl-
Reakcia je priama a nezvratná. Je to charakteristika silnej kyseliny, ktorá je zase silným elektrolytom kvôli jeho úplnej ionizácii vo vode.
Môže vám slúžiť: alifatické uhľovodíky: Vlastnosti, nomenklatúra, reakcie, typySilné základne
Silné základne, ktoré sa rozpúšťajú vo vode bez problémov, musia uvoľniť OH ióny- z rovnakých kryštálov alebo ireverzibilne rozbaliť molekulu vody, ktorá ich generuje.
Mnoho silných základov pozostáva z iónov a nemolekulárnych tuhých látok. Niektoré príklady týchto základní, ktoré sa správajú ako silné elektrolyty, sú:
-Lioh, hydroxid lítium, uvoľňuje OH ióny- a li+
-NaOH, hydroxid sodný, uvoľňuje OH ióny- a na+
-RBOH, rubidio hydroxid, uvoľňuje OH ióny- a RB+
-CA (OH)2, Hydroxid vápenatý, uvoľňujte OH ióny- a ca2+
-SR (OH)2, Hydroxid strontium, uvoľnite OH ióny- a pán2+
-Ba (oh)2, Hydroxid bária, uvoľnite OH ióny- a ba2+
-NAH, hydrid sodný, uvoľňuje OH ióny- a vodíkový plyn, h2
-Nanh2, sodík Amiduro, uvoľnite OH ióny- a amoniakový plyn, NH3
Choď von
Hallobasi Silné elektrolyty, keď sa rozpúšťajú vo vode. Mnohé z nich nevytvárajú zmeny pH. Je to preto, že ich ióny sú veľmi stabilné, takže sa nezúčastňujú na zostatkoch hydrolýzy, aby zmenili povahu vody. Príklady týchto solí sú:
-NaCl, chlorid sodný, uvoľňuje ióny na ióny+ a cl-
-Agno3, Dusičnan strieborný, uvoľňovacie ag ióny+ a nie3-
-Starší brat3, dusičnan sodný, uvoľňujte ióny NA+ a nie3-
-Klimatizovať2SW4, Síran draselný, uvoľňuje K ióny+ A tak42-
-Mgcl2, Chlorid horečnatý, uvoľňuje mg ióny2+ a cl-
-Cuso4, Cupric Sulfát, uvoľňuje ióny Cu2+ A tak42-
-KBR, bromid draselný, uvoľňuje K ióny+ a br-
-NH4CL, chlorid amónny, uvoľňuje NH ióny4+, Cl-, H3Ani+ a plyn amoniaku
Môže vám slúžiť: chlorid ortuti (ii): Štruktúra, vlastnosti, získanie, použitia-NACN, kyanid sodný, uvoľňuje ióny na ióny+ a CN-
-Nat3Po4, Fosforečnan sodný, uvoľňuje ióny+ a po43-
-Kričať3, Chromický chlorid, uvoľňuje Cr ióny3+ a cl-
-Aub3, Auric Bromid, uvoľňuje ióny Au3+ a br-
-SNSO4, Estany sulfát, uvoľňuje SN ióny2+ A tak42-
NH4CL je protichodný príklad: je úplne ionizovaný, ale zároveň vytvára neutrálne molekuly amoniaku, pretože ide o kyslú soľ.
Rozdiely medzi silnými a slabými elektrolytmi
Aj keď boli rozdiely medzi silným elektrolytom slabého nepriamo stanovené, tieto budú uvedené nižšie ako záver:
-Silné elektrolyty sú vo vodách veľmi rozpustné; Slabé elektrolyty nie sú.
-Ionizácia slabého elektrolytu je čiastočná, čo znamená, že v roztoku môžu byť neutrálne molekuly. Namiesto toho silné elektrolyty existujú výlučne ako ióny.
-Slabé kyseliny a bázy, ktoré sú zase slabé elektrolyty, sa úplne nerozlišujú vo vode, takže generujú menej iónov h3Ani+ alebo oh- Čo by sa dalo očakávať.
-HALTH -HALIN SILD ELECTLECTYTY sa v porovnaní so slabými elektrolytmi takmer nevyhynú hydrolyty. Preto sú roztoky bývalých tendenciu byť neutrálne, s výnimkou prípadov, keď sa zaoberajú kyslými alebo základnými soľami.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Silný elektrolyt. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Silná definícia a príklad elektrolytu. Zotavené z: Thoughtco.com
- Chung & Chieh. (5. júna 2019). Elektrolyty. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- « Charakteristiky externého hodnotenia, typy (testy), príklady
- Platón Biografia, filozofia a príspevky »

