Elektrofilové reakcie, príklady, elektrotrofilita
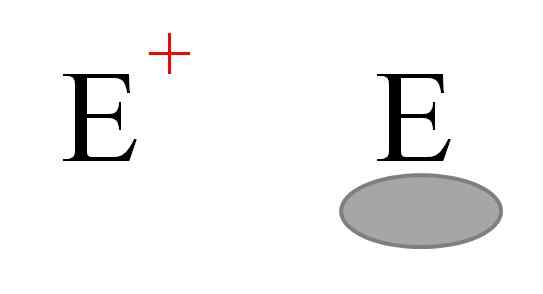
- 826
- 226
- Václav Višňovský
A Elektrofilka Je to všetko, čo chemické druhy (atóm alebo molekula), ktoré vyzerajú úžasne niekoľko elektrónov. Slovo znamená „láska k elektrónom“. Preto bude elektrofajia mať vždy tendenciu vyhrať alebo akceptovať elektróny pri účasti na chemických reakciách.
Čo robí elektrofil, ktorý potrebuje elektróny? Musíte mať nedostatok elektrónov, či už sa prejavuje čiastočným alebo celkovým pozitívnym zaťažením alebo elektronickým produktom voľného pracovného miesta neúplného oktetu valencie. To znamená, že máme niekoľko typov elektrofilov, hoci všetky akceptujú páry elektrónov negatívnych druhov.
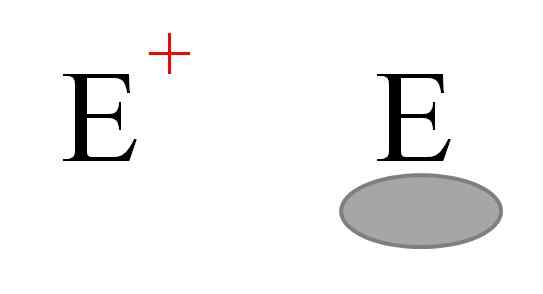 Dva najčastejšie typy elektrofilov v chémii. Zdroj: Gabriel Bolívar.
Dva najčastejšie typy elektrofilov v chémii. Zdroj: Gabriel Bolívar. Všeobecne sú reprezentované dva typy elektrofilov. Obidve sú symbolizované listom a. Ten vľavo zodpovedá kladnej elektrofleii a+. Medzitým ten napravo zodpovedá elektrofilu s elektronickým neobsadeným miestom, ktorý predstavuje šedijský ovál, ktorý naznačuje neprítomnosť elektrónov v orbitáli Valencie.
Kovové katióny sú príkladmi elektrofilov a+, ako aj niektoré polyiatomické ióny, ako je hydrónia, h3Ani+. Alhove molekuly3 a bf3, Na druhej strane sú príkladmi druhého typu elektrofilov, pretože hliník aj atóm bóru majú nedostatok elektrónov, pretože nedokončia oktet Valencia.
[TOC]
Reakcie
Elektrofily reagujú prijímajúce páry atómových elektrónov s vysokou negatívnou hustotou, tj bohatých na elektróny. Tieto negatívne atómy alebo molekuly sa nazývajú nukleofily, nu-, ktoré darujú pár elektrónov na elektrofiu a e e+:
Divoký- + A+ → NU-E
Toto je teoretický základ mnohých organických reakcií, ako je aromatická elektrofilná substitúcia. Nukleofil nemusí byť nevyhnutne anión, ale môže to byť aj neutrálna molekula s elektronegatívnym atómom, ako je dusík.
Môže vám slúžiť: kremík: História, vlastnosti, štruktúra, získanie, použitiePríklady elektrofilov
Lewis Kyseliny
Lewisové kyseliny sú elektrofily, pretože podľa definície prijímajú páry elektrónov. Kovové katióny, mn+, prilákať negatívne oblasti okolitých polárnych molekúl v procesoch solvatácie. Tak, mn+ končí okolitým záporným zaťažením, dokonca prichádza na prijatie elektrónov na vytvorenie koordinačných komplexov.
Cucion Cu2+, Napríklad je to kyselina Lewis a elektrofil, pretože je koordinovaná s atómami kyslíka vody za vzniku komplexnej ACU2)62+. Rovnakým spôsobom sa to stáva s ostatnými katiónmi.
Nie všetky Lewisové kyseliny sú katióny: niektoré sú neutrálne molekuly alebo atómy. Napríklad BF3 Je to Lewisová kyselina a elektrofil, pretože.
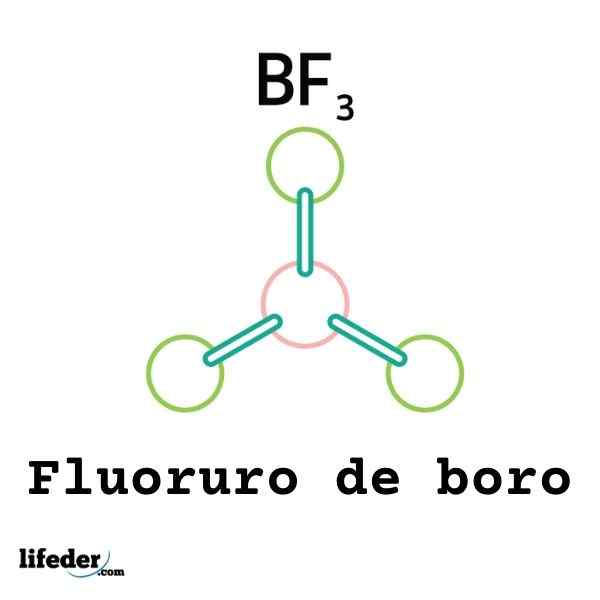
Bude teda spojený s okolitým fluoridovým aniónom, aby sa vytvoril anión Boro tetrafluoruro, bf4-. To znamená, bf3 tvorí odkaz s f- prijatím niekoľkých elektrónov.
Ďalšou elektrofickou je nitronio ión, nie2+, čo je a Elektrofylické činidlo veľmi silné tvorené v nitráčných reakciách benzénu. V tomto ióne má atóm dusíka kladnú záťaž, takže benzénové elektróny rýchlo prijímajú.
Brönsted Kyseliny
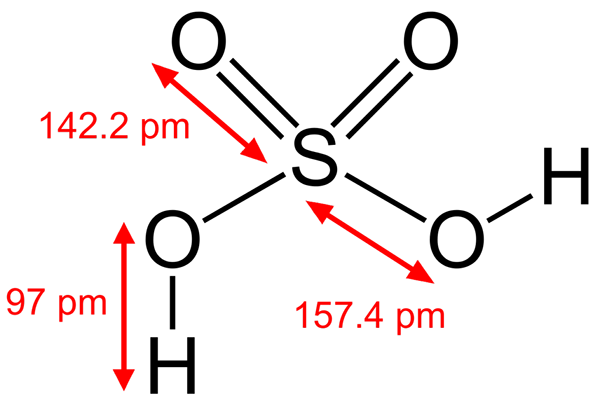 Štruktúra kyseliny sírovej
Štruktúra kyseliny sírovej Niektoré kyseliny Brönsted sú tiež elektrofily. Napríklad katión Hydronium, h3Ani+, Je to elektrofil, pretože atóm kyslíka má kladnú záťaž. Keďže ste veľmi elektronegatívni, budete sa snažiť získať elektróny, ktoré darujú jeden z jeho hydrogénov na transformáciu na molekulu vody.
Ďalšia Brönstedová kyselina, ako je kyselina sírová, h, H2SW4, Je to tiež elektrofil. Atóm síry je vysoko oxidovaný a bude sa snažiť získať elektróny, ktoré darujú jeho dva hydrogény.
Môže vám slúžiť: uhlíkový tetrachlorid (CCL4)Halogény
Halogény (f2, Cl2, Br2 a ja2) Sú elektrofilky. Jeho atómy nemajú elektronické nedostatky; Ich prepojenia sú však nestabilné, pretože oba atómy, X-X, veľmi silne priťahujú k nim elektróny.
Preto halogény reagujú ako oxidačné činidlá, správajú sa ako elektrofily a prijímajú páry elektrónov, aby sa stali halogenidovými aniónmi (F-, Cl-, Br- a ja-).
Halogény však týmto spôsobom nielen vyhrávajú elektróny. Môžu byť tiež spojené s menšími elektronickými atómami ako oni, aby získali čistý zisk elektrónov. Napríklad to je dôvod, prečo sa dajú pridať do dvojitých väzieb alkénov alebo olefinov.
Halogény predstavujú iný typ elektrofie ako dva, ktoré boli zavedené na začiatku. Jeho správanie je však na konci rovnaké ako pre všetky elektrofily: Prijmite páry elektrónov.
Halogenidy prenájmu a vodíka
 Molekuly CFC sú alkyl halogenidy
Molekuly CFC sú alkyl halogenidy Halogenidy prenájmu a vodíka sú elektrofily, v ktorých má halogén spojený atóm+. Je to preto, že halogén, vysoko elektronegatívny, priťahuje elektronickú hustotu susedného atómu na seba samého.
Pre alkylhalogenidov, RX, R bude mať elektronický nedostatok, zatiaľ čo X prebytočné elektróny, rΔ+-XΔ-. Ak sa teda veľmi negatívny druh blíži RX, zaútočí na R, aby sa s ním spojil a prinútil X ako anión.
Tiež v halogenidoch vodíka má HX, vodík má elektronický nedostatok alebo pozitívne čiastočné zaťaženie, hΔ+-XΔ-. Preto negatívne druhy poskytnú svoj elektrón do tohto vodíka a on ich ako elektrofil prijme.
Zlúčeniny
Kyseliny, halogény a halogenidy nie sú jediné molekuly, ktoré sa dajú klasifikovať ako elektrofily. Aj keď nie, oxid uhličitý, CO2, Je to elektrofil, pretože centrálny atóm uhlíka je veľmi oxidovaný, alebo = cΔ+= O.
Môže vám slúžiť: Flaka na pozadíPreto, keď co -2 Reacta to urobí akceptovanie elektrónových párov, buď sa stane karboxylátom, skupinou COOH alebo uhličitanom, co32-.
Okrem CO2, Karbonylové zlúčeniny, ako sú ketóny, aldehydy a estery, sú tiež príkladmi elektrofilov, pretože v nich má uhlík pozitívne čiastočné zaťaženie a má tendenciu akceptovať elektróny veľmi negatívnych druhov.
Karboce
 Atóm metánu uhlíka pozitívne načítaný
Atóm metánu uhlíka pozitívne načítaný Karbocations sú mimoriadne silné Lewisové kyseliny. Existujú terciárne (r3C+), sekundárne (r2HC+) alebo primárne (RH2C+). Uhlík vždy tvorí štyri väzby, takže najmä tento katión sa bude snažiť akýmkoľvek spôsobom akceptovať elektróny.
Elektrotrofilita
Nie všetky elektrofily sú elektrónmi rovnako „hladné“. Niektoré sú reaktívnejšie ako iné. Čím väčší je elektronický nedostatok elektrofilu, tým väčšia je jeho citlivosť na utrpenie nukleofilných útokov negatívnych druhov. To znamená, že bude predstavovať väčšiu elektrofylitu, čo je relatívna miera toho, ako reaktívny je predmetná elektrofilka.
Napríklad karbocations, nitronium a fluorid majú vysokú elektrofylaitu; Zatiaľ čo oxid uhličitý alebo niektoré katióny, ako je sodík, majú nízku elektrofylaciu.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Elektrofilový. Zdroj: In.Wikipedia.orgán
- James Ashenhurst. (2020). Nukleofily a elektrofily. Získané z: Masterorganicchemistry.com
- Profesorka Patricia Sheley. (2012). Nukleofily a elektrofily. University of Illinois. Zotavené z: bután.Chem.Priekopa.Edu
- Danielle Reid. (2020). Elektrofil: Definícia a príklad. Štúdium. Získané z: štúdie.com
- Tim Soderberg. (7. októbra 2019). Elektrofily. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- « Biot-Savart Formula, demonštrácia, aplikácie, cvičenia
- Šelfordov zákon o tolerancii, čo pozostáva a príklady »

