Štruktúra dimetylamínu ((CH3) 2NH), vlastnosti, použitia, riziká
- 4807
- 1105
- Adrián Fajnor
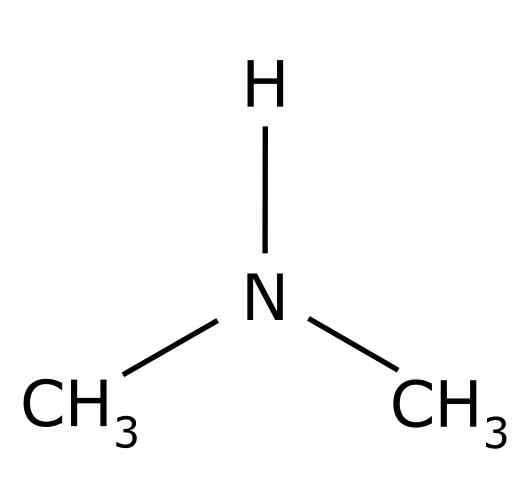
Ten dimetylamín Je to organická zlúčenina tvorená dvoma metylovými skupinami -ch3 United do skupiny -nh skupiny. Jeho chemický vzorec je (CHO3)2NH. Je to bezfarebný plyn. Keď je vo vzduchu vnímaná vôňa rýb pri nízkych koncentráciách. Ak je však vo vysokej koncentrácii, má vôňu amoniaku NH3.
Dimetylamín je prítomný v rastlinách a zvieratách. Predpokladá sa, že v ľudskej bytosti pochádza z rozkladu určitých enzýmov, ale aj z požitia niektorých potravín, ako sú ryby. Ak sa dimetylamínový plyn rozpustí vo vode, tvorí veľmi zásadité a korozívne roztoky.
 Dimetylamín. Ring0 [verejná doména]. Zdroj: Wikimedia Commons.
Dimetylamín. Ring0 [verejná doména]. Zdroj: Wikimedia Commons. Má rôzne priemyselné použitia, ako je výroba rozpúšťadiel, na urýchlenie vulkanizácie gumy.
Dimetilamín je veľmi horľavý plyn. Kontajnery, ktoré ho obsahujú. Okrem toho ich výpary dráždia oči, pokožku a dýchací trakt.
Je to zlúčenina, ktorá môže byť súčasťou atmosférických aerosólov, to znamená veľmi tenkých kvapiek nachádzajúcich sa v atmosfére.
[TOC]
Štruktúra
Dimetilamín je sekundárny alifatický amín. To znamená, že substituenty dusíka (N) sú alifatické (-ch3), čo znamená, že nie sú aromatickí a že sú dvaja. Preto existujú dva metyl -ch3 United Dusík, ktorý má tiež vodík (H).
V molekule dimetylamínu má dusík (N) pár voľných elektrónov, to znamená niekoľko elektrónov, ktoré nie sú zjednotené so žiadnym iným atómom.
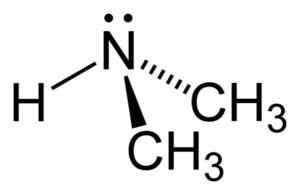 Štruktúra dimetylamínu. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Štruktúra dimetylamínu. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Menovanie
- Dimetylamín
- N, N-dimetylamín
- N-metylmetanamín
- DMA (skratka pre di-metyl-amín).
Vlastnosti
Fyzický stav
Bezfarebný plyn.
Molekulová hmotnosť
45,08 g/mol
Bod topenia
-93 ° C
Bod varu
7,3 ° C
Bod vzplanutia
-6,69 ° C (metóda zatvoreného pohára).
Teplota
400 ° C
Môže vám slúžiť: Zákon viacerých rozmerovHustota
Kvapalina = 0,6804 g/cm3 A 0 ° C.
Para = 1,6 (relatívna hustota vzhľadom na vzduch, vzduch = 1).
Rozpustnosť
Veľmi rozpustné vo vode: 163 g/100 g vody pri 40 ° C. Rozpustný v etanole a etyléteru.
pH
Vodné roztoky dimetylamínu sú silne alkalické.
Disociačná konštanta
Klimatizovaťb = 5,4 x 10-4
Pkdo konjugovanej kyseliny = 10 732 až 25 ° C. Kyselina konjugovaná je ión dimetylamónium: (Cho3) NH2+
Chemické vlastnosti
Kvapalný dimetylamín môže zaútočiť na niektoré plasty, pneumatiky a povlaky.
Pri rozpustení vo vode sa elektrónový pár bez dusíka (N) berie protón (H+) vody, zanecháva Oh zadarmo-, Tvorí teda veľmi zásadité a korozívne riešenia:
Dimetylamín + voda → ión dimetylamónium + hydroxyl ión
(Ch3)2NH + H2O → (Vyberte3)2NH2+ + Oh-
S kyselinou dusičnou sa získava dusičnanová soľ, to znamená dusičnan dimetyla amotylamónium:
Dimetylamín + kyselina dusičná → dusičnan dimetylamónium
(Ch3)2Nh +hno3 → (ch3)2NH2+Nie3-
Ďalšie vlastnosti
Keď má koncentrácia nízkej vzduchu, má zápach podobnú ryby, zatiaľ čo vo vysokých koncentráciách vonia ako amoniak (NH3).
Biochemické reakcie
V organizme môže dimetylamín trpieť nitrillárnymi podmienkami za slabo kyslých podmienok, aby sa poskytol zlúčenina dimetylnitrozamínu karcinogénovej zlúčeniny (CH (CH3)2N-no.
Tvorba dimetlnitrozamínu sa vyskytuje z dimetylamínu a dusitanu (dusitan sodný) v žalúdku (A pH 5-6) pôsobením baktérií existujúcich v gastrointestinálnom trakte. V niektorých potravinách je prítomný dusitan sodný.
Dimetylamín + dusitan sodný → dimetylnitrozamín + hydroxid sodný
(Ch3)2NH + nano2 → (ch3)2N-no + naoh
Získanie
Dimetilamín sa komerčne pripravuje reagovaním metanolu (vyberte si3Och) s amoniakom (NH3) pri 350-450 ° C v prítomnosti katalyzátora oxidu kremičitého a hliniaka (SIO2/Do2Ani3).
2 ch3Oh + NH3 → (ch3)2NH + 2 h2Ani
Pretože sa tiež vyrábajú monometylamín a trimetylamín, vykonáva sa čistenie v sérii štyroch až piatich destilačných stĺpcov.
Prítomnosť v prírode
Dimetylamín sa nachádza v rastlinách a zvieratách. Je tiež prítomný prirodzene a hojne v ľudskom moči.
Môže vám slúžiť: epoxid: nomenklatúra, získanie, aplikácie, príkladyOdhaduje sa, že jeho prítomnosť u ľudí je spôsobená skutočnosťou, že niektoré druhy črevných baktérií sa vyrábajú z niektorých zlúčenín nachádzajúcich sa v potravinách.
Niektoré z týchto zlúčenín sú kopec (zlúčenina, ktorá je spojená so skupinou B) a oxidom trimetylamínom. Tiež sa verí, že pochádza z enzýmu inhibítora oxidu dusnatého (NO), ktorý sa tvorí v tele.
Niektoré zdroje informácií naznačujú, že zvýšenie dimetylamínu v moči je spôsobené požitím rýb a ovocia mora, kde sa získajú hlavné hodnoty, keď jedia chobotnice, hake, sardinky, mečfish, tresku, ryby a líniu.
 Jesť ryby by mohlo zvýšiť hladinu dimetylamínu v moči. Autor: Anna Sulencha. Zdroj: Pixabay.
Jesť ryby by mohlo zvýšiť hladinu dimetylamínu v moči. Autor: Anna Sulencha. Zdroj: Pixabay. Pacienti s nadmerným dimetylamínom
Predpokladá sa, že dimetylamín je uremický toxín, to znamená látka, ktorá môže spôsobiť poškodenie, ak sa zvýši koncentrácia v moči. V skutočnosti boli u pacientov s ochorením obličiek pozorované veľmi vysoké hladiny dimetylamínu v terminálnom štádiu.
Predpokladá sa, že u týchto pacientov môže dôjsť.
Žiadosti
DMA alebo DMA sa používa pre:
- Príprava ďalších zlúčenín.
- Výroba rozpúšťadiel dimetylformamidu a dimetylacetamidu.
- Urýchliť vulkanizáciu určitých ďasien.
- Eliminujte vlasy počas opaľovania.
- Pôsobiť ako antioxidant pre rozpúšťadlá.
- Slúži ako minerálne flotačné činidlo.
- Inhibovať koróziu a ako anti -Sniff agent.
- Funkcia ako povrchovo aktívna látka.
- Vyrábať mydlá a detergenty.
- Pôsobiť ako chemik v textile.
- Funkcia ako anti -datingové činidlo v palivách a stabilizátor plynu.
- Pripraviť farbivá.
- Absorbovať kyslé plyny.
- Podávame ako pesticídy a rakety.
- Byť súčasťou činidiel na úpravu vody.
- Pôsobiť ako fungicíd v agrochemických výrobkoch.
- Už prerušené použitia, ako je priťahovanie a vyhladenie Gorgjosov alebo hmyzu, ktoré útočia na bavlnu.
 Bavlnená rastlina. Autor: Isaa KC. Zdroj: Pixabay.
Bavlnená rastlina. Autor: Isaa KC. Zdroj: Pixabay.  V minulosti boli hmyz, ktorý útočil na bavlnené rastliny, eliminovali dimetylamínom. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
V minulosti boli hmyz, ktorý útočil na bavlnené rastliny, eliminovali dimetylamínom. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Riziká
Dimetilamínové výpary sú dráždivé pokožky, oči a dýchací trakt.
Môže vám slúžiť: anorganické zlúčeninyAk sa dostanete do kontaktu s pokožkou v tekutej forme, môže spôsobiť zmrazenie a chemické popálenie. Jeho vdýchnutie má nepriaznivé účinky na zdravie.
Plyn DMA je korozívny a môže tvoriť korozívne vodné roztoky. Vaše vodné roztoky sa môžu stať horľavou, pokiaľ nie sú celkom zriedené.
Dimetylamín tvare plynu je ľahko zapálený produkciou toxických výparov oxidov dusíka (nieX).
Ak je kontajner obsahujúci tento plyn vystavený intenzívnemu tepla alebo tepla, môže explodovať.
Vplyv DMA v atmosfére
Atmosférický aerosól (veľmi malé kvapky zmesi prírodných zlúčenín a/alebo znečisťujúcich látok v atmosfére) má hlboký vplyv na globálnu klímu a kvalitu ovzdušia v rôznych oblastiach sveta.
Tvorba nových aerosólových častíc ešte nie je úplne pochopená.
Odhaduje sa, že dimetylamín sa zúčastňuje spolu s inými zlúčeninami na tvorbe týchto častíc, čo sa zdá, že závisí od oblasti silných emisií DMA.
Napríklad v priemyselných oblastiach je väčšia koncentrácia ako v poľnohospodárskych oblastiach, čo môže ovplyvniť spôsob, akým sa DMA zúčastňuje.
Je potrebné poznamenať, že podľa niektorých vedcov môže spaľovanie rastlinného materiálu obsahujúceho glyfosát (jeden z herbicídov, ktoré sa najviac používa na svete), viesť k tvorbe dimetylamínu.
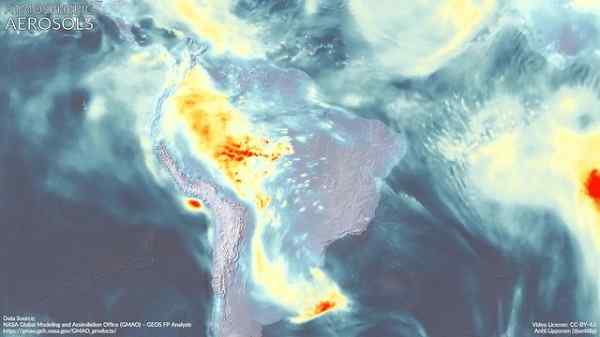 Atmosférické aerosóly v Južnej Amerike. Dimetilamín by mohol prispieť k jeho tvorbe. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Atmosférické aerosóly v Južnej Amerike. Dimetilamín by mohol prispieť k jeho tvorbe. Marvinbikolano [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Dimetylamín. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Štvrté vydanie. John Wiley & Sons.
- Morrison, r.Tón. a Boyd, r.N. (2002). Organická chémia. 6. vydanie. Hara.
- Windholz, m. a kol. (redaktori) (1983). Index Merck. Enyklopedia chemikálií, liekov a biologických. Desiate vydanie. Merck & Co., Inc.
- Abrawitz, m.Klimatizovať. a kol. (2010). Patofyziológia urémie. Alifatické amíny. Pri chronických ochoreniach obličiek, dialýze a transplantácii (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Li, h. a kol. (2019). Vplyv atmosférických podmienok na novú tvorbu nových častíc založených na kyseline sírovej-dimetylamín-amonia. Chosfer 2019; 245: 125554. NCBI sa zotavila.NLM.NIH.Vláda.
- Mackie, J.C. a Kennedy a.M. (2019). Pyrolýza glyfosátu a piesní toxické výrobky. Prostredie. Sci. Technológia. 2019: 53 (23): 13742-13747. NCBI sa zotavila.NLM.NIH.Vláda.

