Rozdiely medzi organickými a anorganickými zlúčeninami

- 3788
- 830
- Gabriel Bahna
Ten Rozdiely medzi organickými a anorganickými zlúčeninami Nie sú vždy jednoduché, ani sa nedodržiavajú nemenné pravidlo, pretože pokiaľ ide o chémiu. Existujú však vlastnosti, ktoré umožňujú rozlíšiť medzi mnohými zlúčeninami, ktoré alebo nie anorganické.
Podľa definície je organická chémia štúdia, ktorá zahŕňa všetky odvetvia chémie uhlíka; Preto je logické myslieť si, že ich kostry sú zložené z atómov uhlíka. Na druhej strane, anorganické kostry (bez vstupu do polymérov) sa zvyčajne skladajú z akéhokoľvek iného prvku periodickej tabuľky ako uhlíka.
Živé bytosti sú na všetkých ich mierkach a výrazoch prakticky vyrobené z uhlíka a iných heteroátomos (H, O, N, P, S atď.). Takže všetka zeleň, ktorá pokrýva zemskú kôru, ako aj tvory, ktoré chodia, sú živými príkladmi komplexných a dynamicky premiešaných organických zlúčenín.
Na druhej strane, vŕtanie Zeme a v horách nachádzame bohaté minerálne telá v zložení a geometrických tvaroch, ktoré sú vo svojej veľkej väčšine anorganických zlúčenín. Ten tiež definuje takmer úplne atmosféru, ktorú dýchame, a oceány, rieky a jazerá.
Organické zlúčeniny | Anorganické zlúčeniny | |
Atómy, ktoré ho skladajú | Obsahujú atómy uhlíka. | Sú tvorené z iných prvkov ako uhlíka. |
Sú súčasťou .. | Sú súčasťou živých bytostí. | Sú súčasťou inertných bytostí. |
Zdroje, v ktorých sú | Sú menej hojné v prírodných zdrojoch. | Sú hojnejšie v prírodných zdrojoch. |
Typy zlúčenín | Zvyčajne sú molekulárne. | Zvyčajne sú iónové. |
Typy odkazov | Kovalentné odkazy. | Iónové odkazy. |
Molárne masy | Väčšie molárne masy. | Nižšie molárne masy. |
Rôznorodosť | Sú menej rozmanité. | Sú rôznorodejšími prvkami. |
Fúzne a varné body | Menšie body fúzie a varu. | Vyššia fúzia a body varu. |
Hlavné rozdiely medzi organickými a anorganickými zlúčeninami
Anorganické zlúčeniny sa získavajú z prírodných zdrojov hojnejších ako základy anorganických zlúčenín
 Cukrové kryštály (vpravo) a soľ (vľavo) pozorované v mikroskope. Zdroj: Oleg Panichev [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Cukrové kryštály (vpravo) a soľ (vľavo) pozorované v mikroskope. Zdroj: Oleg Panichev [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Aj keď môžu existovať výnimky, anorganické zlúčeniny sa zvyčajne získavajú z prírodných zdrojov hojnejších ako pre organické zlúčeniny. Tento prvý rozdiel vedie k nepriamemu vyhláseniu: Anorganické zlúčeniny sú hojnejšie (na Zemi a vo vesmíre) ako organické zlúčeniny.
Samozrejme, v mieste oleja prevládajú uhľovodíky a súvisiace prevládajúce, čo sú organické zlúčeniny.
Po návrate do sekcie sa dá uviesť ako príklad na slade cukru. Nadmerné kryštály cukru (robustnejšie a fazetované) a soľ sú uvedené vyššie (menšie a zaoblené).
Cukor sa získa po sérii procesov z plantáží z cukrovej trstiny (v slnečných alebo tropických oblastiach) a cukrovej repy (v chladných oblastiach alebo na začiatku zimy alebo jesene). Obidve sú prírodné a obnoviteľné suroviny, ktoré sa pestujú až do ich správnej úrody.
Môže vám slúžiť: štandardizácia riešeníMedzitým soľ pochádza z oveľa hojnejšieho zdroja: more alebo jazerá a soli, ako je minerál Halita (NaCl). Keby sa zhromaždili všetka cukrová trstina a cukrová repa, nikdy sa nemohli zhodovať s prírodnými rezervami soli.
Anorganické kryštály sú zvyčajne iónové, zatiaľ čo organické kryštály majú tendenciu byť molekulárne
Ako príklad, keď vezmeme opäť páru cukru, vieme, že cukor pozostáva z disacharidu nazývaného sacharóza, ktorý sa zase rozpadá na glukózovú jednotku a ďalšiu fruktózu. Cukrové kryštály sú molekulárne, pretože sú definované sacharózou a ich intermolekulárnymi vodíkovými mostmi.
Medzitým tvoria slané kryštály na iónovú sieť+ a cl-, ktoré definujú kubickú štruktúru zameranú na tváre (FCC).
Ústredným bodom je, že anorganické zlúčeniny zvyčajne tvoria iónové kryštály (alebo aspoň majú vysoký iónový charakter). Existuje však niekoľko výnimiek, napríklad Co Crystals2, H2S, tak2 a ďalšie anorganické plyny, ktoré stuhnú pri nízkych teplotách a vysokých tlakoch a sú tiež molekulárne.
Voda predstavuje najdôležitejšiu výnimku z tohto bodu: ľad je anorganický a molekulárny kryštál.
 Niekoľko snehu alebo ľadu sú kryštály vody, vynikajúce príklady anorganických molekulárnych kryštálov. Zdroj: sieverschar de Pixabay.
Niekoľko snehu alebo ľadu sú kryštály vody, vynikajúce príklady anorganických molekulárnych kryštálov. Zdroj: sieverschar de Pixabay. Minerály sú v podstate anorganické zlúčeniny, a ich kryštály sú preto prevažne iónové v prírode. Preto sa tento druhý bod považuje za platný pre široké spektrum anorganických zlúčenín vrátane soli, sulfidov, oxidov, teluros atď.
Typ spojenia, ktorý sa riadi v organických zlúčeninách, je kovalentný
Rovnaké kryštály cukru a soli zanechávajú niečo otázky: prvá obsahuje kovalentné (smerové) odkazy, zatiaľ čo druhé vykazujú iónové (neosmerové) odkazy (nesmerné).
Tento bod priamo koreluje s druhým: molekulárny kryštál musí mať nevyhnutne viac kovalentných väzieb (zdieľanie niekoľkých elektrónov medzi dvoma atómami).
Organické soli opäť stanovujú určité výnimky, pretože majú tiež silne iónový charakter; Napríklad benzoát sodný (C6H5Pata) je organická soľ, ale v rámci benzoátu a jeho aromatický kruh sú kovalentné väzby. Napriek tomu sa hovorí, že ich kryštály sú iónové vzhľadom na elektrostatickú interakciu: C6H5Coo- Nat+.
V organických zlúčeninách prevládajú kovalentné väzby medzi atómami uhlíka
Alebo to, čo sa hovorí: Organické zlúčeniny pozostávajú z uhličitého kostry. V nich je viac ako jedna väzba C-C alebo C-H a táto kostra môže byť lineárna, upevnená alebo rozvetvená, mení sa v stupni ich nenasýtenia a typu substituentu (heteroaátomos alebo funkčné skupiny). V cukor, C-C, C-H a C-OH.
Môže vám slúžiť: Redukcia agenta: Koncept, najsilnejšie príkladyUveďte ako príklad Co, ch2Okradnúť2 a h2C2Ani4. Ktoré z týchto troch zlúčenín sú anorganické?
V Ch2Okradnúť2 (etylénový oxid) Existujú štyri väzby C-H a dve spojenia C-O, zatiaľ čo v h2C2Ani4 (Kyselina oxalová) Existuje jeden C-C, dva C-OH a dva C = o. Štruktúra H2C2Ani4 Môže byť napísaný ako HOOC-COOH (dve prepojené karboxylové skupiny). Medzitým CO pozostáva z molekuly, ktorá je zvyčajne znázornená hybridnou väzbou medzi C = O a C≡o.
Pretože v CO (oxid uhoľnatý) je iba atóm uhlíka spojený s jedným z kyslíka, tento plyn je anorganický; Ostatné zlúčeniny sú organické.
Organické zlúčeniny majú zvyčajne väčšie molárne masy
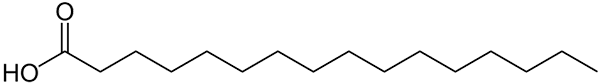 Štruktúra predstavovaná líniami kyseliny palmitovej. Veľkú vec, ktorá sa porovnáva s menšími anorganickými zlúčeninami, alebo je možné si všimnúť hmotnosť vzorec jeho soli. Zdroj: Wolfgang Schaefer [verejná doména]
Štruktúra predstavovaná líniami kyseliny palmitovej. Veľkú vec, ktorá sa porovnáva s menšími anorganickými zlúčeninami, alebo je možné si všimnúť hmotnosť vzorec jeho soli. Zdroj: Wolfgang Schaefer [verejná doména] Opäť platí, že z týchto pravidiel existuje veľa výnimiek, ale zvyčajne majú organické zlúčeniny tendenciu mať väčšie molárne masy kvôli ich sýtenej kostru.
Napríklad stoličky vyššie uvedených zlúčenín sú: 28 g/mol (CO), 90 g/mol (H2C2Ani4) a 60 g/mol (vyberte2Okradnúť2). Samozrejme, CS2 (Disulfid uhlíka), anorganická zlúčenina a ktorej molárna hmota je 76 g/mol, „váži“ viac ako Cho2Okradnúť2.
Ale čo tuky alebo mastné kyseliny? Biomolekúl, ako je DNA alebo proteíny? Alebo rozsiahle uhľovodíky lineárneho reťazca? Alebo asfaltén? Jeho molárne hmoty ľahko presahujú 100 g/mol. Kyselina palmitová (napríklad horný obrázok) má molárne cesto 256 g/mol.
Organické zlúčeniny sú v počte hojnejšie
Niektoré anorganické zlúčeniny, nazývané koordinačné komplexy, predstavujú Isomeía. Je to však menej rozmanité v porovnaní s organickými izomériami.
Aj keď pridáme všetky soli, oxidy (kovové a nemetalické), sulfidy, telururos, karbidy, hydridy, nitridy atď., Nebudeme sa zhromažďovať, možno ani polovica organických zlúčenín, ktoré môžu existovať v prírode. Preto sú organické zlúčeniny hojnejšie v počte a bohatšie na štruktúry.
Anorganické zlúčeniny sú elementárne rozmanitejšie
Podľa elementárnej diverzity sú však anorganické zlúčeniny rôznorodejšie. Pretože? Pretože s periodickou tabuľkou v ruke môžete zostaviť akýkoľvek typ anorganickej zlúčeniny; Zatiaľ čo organická zlúčenina je obmedzená iba na prvky: C, H, O, P, S, N a X (Halogény).
Máme veľa kovov (alkalické, alkalinery, prechod, lantanidy, aktinidy, blokové P) a nekonečné možnosti ich kombinovať s niekoľkými aniónmi (obyčajné anorganické); ako: CO32- (Uhličitany), CL- (Chloridy), P3- (fosfores), alebo2- (oxidy), oh- (hydroxidy), tak42- (sulfáty), CN- (kyanidy), SCN- (Tiociamáty) a mnoho ďalších.
Všimnite si, že anióny CN- a SCN- Zdá sa, že sú organické, ale v skutočnosti sú anorganické. Ďalším zmätkom je oxalátový anión, c2Ani42-, čo je organické a neinorganické.
Môže vám slúžiť: Diagonálne pravidloAnorganické zlúčeniny majú vyššie body fúzie a varu
Opäť platí, že z tohto pravidla existuje niekoľko výnimiek, pretože všetko závisí od toho, ktorá pár zlúčenín sa porovnáva. Avšak, keď sa drží na anorganických a organických soli, prvé majú zvyčajne väčšie fúzne a varné body ako druhé.
Tu nájdeme ďalší implicitný bod: Organické soli sú náchylné na rozklad, pretože teplo prelomí svoje kovalentné väzby. Napriek tomu porovnávame tartrato vápnik (CAC4H4Ani6) a uhličitan vápenatý (CACO3). CAC4H4Ani6 Rozkladá sa pri 600 ° C, zatiaľ čo Caco3 Topí sa pri 825 ° C.
A že Caco3 nie je ani zďaleka jedným zo solí s najvyššími bodmi topenia, ako v prípade CAC2 (2160 ° C) a CAS2 (2525 ° C): Carburo a sulfid vápenatý.
Organické zlúčeniny sú vo vesmíre zriedkavejšie
Najjednoduchšie a najprimitívnejšie organické zlúčeniny, ako je metán, Cho4, Močovina, co (NH2)2, alebo aminokyselinová glycina, NH2Chvály2CoOH, sú veľmi zriedkavé druhy vo vesmíre v porovnaní s amoniakom, oxidom uhličitým, oxidmi titánu, uhlie atď. Vo vesmíre nie sú často zistené ani prekurzorové materiály života.
Organické zlúčeniny podporujú život v oveľa väčšej miere ako anorganické
 Služba Morrocoy pozostáva zo zmesi kostí pokrytých keratínom, ktoré sa skladajú z anorganickej matrice (hydroxyapatit a príbuzných minerálov) a organických (kolagén, chrupavka a nervy). Zdroj: MorroCoy_ (geochelone_carbonary).JPG: Fotografia.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Služba Morrocoy pozostáva zo zmesi kostí pokrytých keratínom, ktoré sa skladajú z anorganickej matrice (hydroxyapatit a príbuzných minerálov) a organických (kolagén, chrupavka a nervy). Zdroj: MorroCoy_ (geochelone_carbonary).JPG: Fotografia.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Chémia uhlíka, organická, aplikovaná v porozumení metabolických procesov, stáva sa biochémiou (az hľadiska kovových katiónov v bioinorganickom).
Organické zlúčeniny sú základným kameňom života (ako je morrocoy horného obrázka), vďaka spojením C-C a obrovskému konglomerátu štruktúr vyplývajúcich z týchto spojení a jeho interakcie s kryštálmi anorganických solí.
Pri návrate k páru so slanou cukrom sú prírodné zdroje cukru nažive: sú to plodiny, ktoré sa vyvíjajú a zomierajú; So zdrojmi soli sa však nestane rovnako: moria alebo soľné ložiská sú nažive (vo fyziologickom zmysle).
Rastliny a zvieratá syntetizujú nekonečné organické zlúčeniny, ktoré integrujú rozsiahlu škálu prírodných produktov (vitamíny, enzýmy, hormóny, tuky, farbivá atď.).
Nemôžeme však vynechať skutočnosť, že voda je rozpúšťadlom života (a je anorganická); Ani kyslík nie je nevyhnutný pre bunkové dýchanie (bez pomenovania kovových kofaktorov, ktoré nie sú anorganickými zlúčeninami, ale katiónmi). Preto Anorganic tiež zohráva rozhodujúcu úlohu v definícii života.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- HelMestine, Anne Marie, PH.D. (3. júla 2019). Rozdiel medzi organickými a anorganickými. Zotavené z: Thoughtco.com
- Agentúra pre vzdelávanie v Texase. (2019). Organický alebo anorganický? Získané z: Texasgateway.orgán
- Sacharóza. (s.F.). Ako sa vyrába cukor: Úvod. Získané z: sázy.com
- Wikipedia. (2019). Zoznam anorganických zlúčenín. Zdroj: In.Wikipedia.orgán
- « Rozdiely medzi rýchlosťou a rýchlosťou (s príkladmi)
- 10 dynamiky emocionálnej inteligencie pre deti a dospelých »

