Aké sú zákony o hmotnosti chémie? (Príklady)

- 4490
- 711
- MUDr. Miloslav Habšuda
Ten Nosené zákony chémie Sú to tie, ktoré ukázali, že masy látok, ktoré reagujú, tak nerobia svojvoľne alebo náhodne; ale udržiavanie konštantného matematického podielu celých čísel alebo ich submultiek, v ktorých sa atómy prvkov nevytvárajú ani zničujú.
V minulých časoch stanovenie týchto zákonov si vyžadovalo mimoriadne úsilie o zdôvodnenie; Pretože aj keď sa teraz zdá príliš zrejmé, pred atómovými alebo molekulárnymi hmotami prvkov alebo zlúčenín neboli ani známe, respektíve, respektíve.
 Zdroj: Jeff Keyzer z Austin, TX, USA [CC BY-SA 2.0 (https: // creativeCommons.Org/licencie/By-SA/2.0)]
Zdroj: Jeff Keyzer z Austin, TX, USA [CC BY-SA 2.0 (https: // creativeCommons.Org/licencie/By-SA/2.0)] Pretože nebolo známe, ako presne mol atómov každého prvku boli rovnocenné, chemikálie osemnásteho a devätnásteho storočia museli byť založené na reagujúcich masách. Takže základné analytické stupnice (vynikajúci obraz) boli neoddeliteľnými spoločníkmi počas stoviek experimentov potrebných na urovnanie váhových zákonov.
Z tohto dôvodu, že keď sa študujú tieto zákony chémie, narazili na hmotnostné merania v každom okamihu. Vďaka tomu, extrapolovanie výsledkov experimentov, sa zistilo, že chemické zlúčeniny Čistý Vždy sa tvoria s rovnakým hmotnostným podielom svojich volebných prvkov.
[TOC]
Zákon o zachovaní omše
Tento zákon hovorí, že pri chemickej reakcii sa celková hmotnosť reagencií rovná celkovej hmotnosti výrobkov; Pokiaľ je systém uvažovaný za uzavretý a nedochádza k výmene hmotnosti a energie so svojím okolím.
V chemickej reakcii látky nezmiznú, ale transformujú sa na iné látky rovnakej hmoty; Odtiaľ slávna fráza: „Nič nie je vytvorené, nič nie je zničené, všetko sa transformuje“.
Z historického hľadiska zákon o zachovaní hromadnej ochrany v chemickej reakcii prvýkrát navrhol v roku 1756 Michail Lomonsov, ktorý vo svojom denníku ukázal výsledky svojich experimentov.
Následne v roku 1774 predstavil francúzsky chemik Antoine Levoisier výsledky svojich experimentov, ktoré to umožnili zistiť; ktoré to tiež nazývajú Lavoisierov zákon.
-Lavoisier experimenty
V čase Lavoisiera (1743-1794) bola teória Flogista, podľa ktorej mali telá schopnosť zapáliť alebo spáliť. Lavoisier experimenty umožňujú zlikvidovať túto teóriu.
Lavoisier uskutočnil početné experimenty s kovovými spaľovačmi. Opatrne zvážil materiály pred a po jeho spaľovaní v uzavretej nádobe a zistil, že došlo k zjavnému nárastu hmotnosti.
Ale Lavoiser na základe znalostí úlohy kyslíka v spaľovaní dospel k záveru, že prírastok hmotnosti pri spaľovaní bol spôsobený začlenením kyslíka do spaľovacieho materiálu. Zrodil sa koncept oxidov kovov.
Preto súčet hmôt kovov vystavených spaľovaniu a kyslíku zostal nezmeniteľný. Tento záver umožnil stanovenie zákona o hromadnej ochrane.
-Vyváženie rovníc
Zákon o hromadnej ochrane zavedený potreba vyvážiť chemické rovnice, ktoré zaručuje, že počet všetkých prvkov zapojených do chemickej reakcie, ako aj činidlá alebo výrobky, je presne rovnaký.
Toto je zásadná požiadavka na presnosť vykonaných stechiometrických výpočtov.
-Výpočty
Mol vody
Koľko mólov vody sa môže vyskytnúť počas spaľovania 5 mólov metánu v nadbytočnom kyslíku? Tiež ukazuje, že zákon o zachovaní hmoty je splnený.
Chvály4 + 2 o2 => Co2 + 2 h2Ani
Pozorovanie vyváženej rovnice reakcie sa dospelo k záveru, že 1 mol metánu produkuje 2 móly vody.
Problém je možné vyriešiť priamo jednoduchým prístupom, pretože nemáme 1 mol, ale 5 mólov Cho4:
Móly vody = 5 mólov Cho4· (2 móly H2O / 1 mol Cho4)
= 10
Čo by bolo rovnocenné 180 g z H2Ani. Vytvorilo sa tiež 5 mol alebo 220 g CO2, čo sa rovná celkovej hmotnosti 400 g výrobkov.
Preto pre zákon ochrany subjektu reagovať 400 g reagencií; nie viac nie menej. Z týchto 400 g, 80 g zodpovedá 5 mólom Cho4 (násobenie jeho molekulárnou hmotnosťou 16 g/mol) a 320 g pri 10 móloch O2 (Podobne kvôli jeho molekulárnej hmotnosti 32 g/mol).
Spaľovanie horčíkovej pásky
Horčík s 1,50 g horčíka spaľovaná v uzavretej nádobe obsahujúcej 0,80 g kyslíka. Po spaľovaní bolo v nádobe 0,25 g kyslíka. a) Čo reagovala hmotnosť kyslíka? b) Koľko sa vytvorilo oxid horečnatý?
Môže vám slúžiť: hypotonické riešenie: komponenty, príprava, príkladyHmotnosť kyslíka, ktorá reagovala, sa získa jednoduchým rozdielom.
Spotrebovaná hmota kyslíka = (počiatočná hmotnosť - zvyšková hmota) kyslík
= 0,80 g - 0,25 g
= 0,55 g alebo2 (TO)
Podľa zákona o masovej ochrane,
Hmotnosť oxidu horečnatý = hmotnosť horčíka +kyslík hmotnosť
= 1,50 g + 0,55 g
= 2,05 g mgo (b)
Zákon o definitívnych rozmeroch
Joseph Louis Proust (1754-1826), francúzsky chemik, si uvedomil, že v chemickej reakcii chemické prvky vždy reagujú v pevných rozmeroch hmotnosti za vzniku zlúčeniny čistý špecifický; Preto je jeho zloženie konštantné, bez ohľadu na zdroj alebo pôvod alebo ako sa syntetizuje.
Proust v roku 1799 uviedol zákon o definovaných rozmeroch, v ktorom sa uvádza, že: „Keď sa kombinujú dva alebo viac prvkov, aby vytvorili zlúčeninu, robia tak vo vzťahu s pevnou hmotnosťou“. Tento vzťah je teda pevný a nezávisí od stratégie sledovanej na prípravu zlúčeniny.
Tento zákon je tiež známy ako zákon konštantného zloženia, ktorý uvádza, že: „Každá chemická zlúčenina v čistote vždy obsahuje rovnaké prvky, v konštantnom podiele hmotnosti“.
-Ilustrácia zákona
Železo (viera) reaguje so síry (S) za vzniku sulfidu železa (FES), je možné indikovať tri situácie (1, 2 a 3):
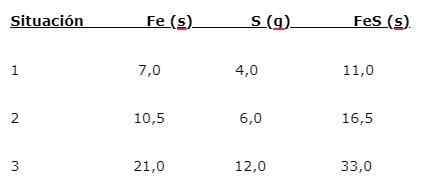
Na nájdenie pomeru, v ktorom sú prvky kombinované, je hlavná hmota (viera) vydelená menšou hmotnosťou (s). Výpočet poskytuje podiel 1,75: 1. Táto hodnota sa opakuje v troch uvedených podmienkach (1, 2 a 3), kde sa získa rovnaký podiel, hoci sa používajú rôzne hmotnosti.
To znamená, že 1,75 g viery sa kombinuje s 1,0 g z S, aby sa dalo 2,75 g FES.
-Žiadosti
Prostredníctvom žiadosti tento zákon môžete presne vedieť masy prvkov, ktoré sa musia kombinovať, aby sa získala požadovaná hmotnosť zlúčeniny.
Týmto spôsobom je možné získať informácie o zvyšnej hmotnosti ktoréhokoľvek z prvkov zapojených do chemickej reakcie, alebo ak v reakcii existuje obmedzujúce činidlo.
Okrem toho sa uplatňuje na poznanie storočia zloženia zlúčeniny a na základe druhej je možné stanoviť vzorec zlúčeniny zlúčeniny.
Storočie zloženia zlúčeniny
Oxid uhličitý (CO2) sa tvorí v nasledujúcej reakcii:
C +o2 => Co2
12 g uhlíka 32 g kyslíka sa kombinuje, aby sa získalo 44 g oxidu uhličitého.
Percento uhlíka sa teda rovná
Percento uhlíka = (12 g / 44 g) · 100 %
= 27,3 %
Percento kyslíka = (32 g / 44 g) · 100 %
Percento kyslíka = 72,7 %
Pomocou vyhlásenia zákona o konštantnom zložení je možné poznamenať, že oxid uhličitý sa vždy tvorí o 27,3 % uhlíka a 72,7 % kyslíka.
-Výpočty
Oxid síry
Reakciou v rôznych nádobách 4 g a 6 g síry (S) s kyslíkom (O) sa získali, respektíve 10 g a 15 g trioxidu siričitého (SO SO3).
Prečo boli také množstvá siričitého oxidu a nie iní?
Vypočítajte tiež množstvo síry potrebné na kombinovanie s 36 g kyslíka a získaného cesto trikxidu sírového.
Časť A)
V prvej nádobe sa zmieša 4 g g kyslíka, aby sa získalo 10 g trioxidu. Ak sa uplatňuje zákon o zachovaní hromadnej ochrany, môžeme vyčistiť kyslíkovú hmotu, ktorá bola kombinovaná so sírom.
Hmotnosť kyslíka = 10 g kyslíkového oxidu - 4 g síry.
= 6 g
V nádobe 2 6 g síry sa zmieša s xg kyslíka, aby sa získal oxid 15 siričitého.
Hmotnosť kyslíka = 15 g oxidu siričitého - 6 g síry
= 9 g
Potom sa vypočítajú proporcie o/s pre každý kontajner:
Podiel O / S V situácii 1 = 6 g o / 4 g s
= 1,5 / 1
Podiel O / S V situácii 2 = 9 g o / 6 g s
= 1,5 / 1
Čo, súhlasí s tým, čo sa vyvoláva v zákone definovaných rozmerov, čo naznačuje, že prvky sú vždy kombinované v rovnakom pomere k vytvoreniu určitej zlúčeniny.
Získané hodnoty sú preto správne a hodnoty, ktoré zodpovedajú uplatňovaniu zákona.
Časť B)
V predchádzajúcej časti sa vypočítala hodnota 1,5 / 1 pre pomer O / s.
Môže vám slúžiť: stavy agregácie hmotyg síry = 36 kyslíka · (1 g síry / 1,5 g kyslíka)
= 24 g
g oxidu siričitého = 36 g kyslíka + 24 g síry
= 60 g
Chlór a horčík
Chlór a horčík sa kombinujú v podiele 2,95 g chlóru pre každé g horčíka. a) Stanovte hmotnosti chlóru a horčíka potrebné na získanie 25 g chloridu horečnatého. b) Aké je percentuálne zloženie chloridu horečnatého?
Časť A)
Na základe hodnoty 2,95 pre pomer CL: MG je možné urobiť tento prístup:
2,95 g Cl +1 g Mg => 3,95 g mgcl2
Potom:
g Cl = 25 g MgCl2 · (2,95 g Cl / 3,95 g mgcl2)
= 18,67
G Mg = 25 g MgCl2 · (1 g mg / 3,95 g mgcl2)
= 6,33
Potom sa 18,67 g chlóru kombinuje so 6,33 g horčíka, čím sa vytvorí 25 g chloridu horčíka.
Časť B)
Molekulová hmotnosť chloridu horečnatého, MGCL sa vypočíta najskôr2:
MGCl Molekulová hmotnosť2 = 24,3 g/mol + (2,35,5 g/mol)
= 95,3 g/mol
Percento horčíka = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Percento chlóru = (71 g / 95,3 g) x 100 %
= 74,5 %
Zákon viacerých rozmerov alebo zákon Dalton
Zákon uviedol v roku 1803 francúzsky chemik a meteorológ John Dalton na základe jeho pozorovaní týkajúcich sa reakcií atmosférických plynov.
Zákon bol uvedený takto: „Keď sú prvky kombinované, aby poskytli viac ako jednu zlúčeninu, variabilná hmotnosť jedného z nich sa spája s pevnou hmotnosťou druhej a prvá má ako vzťah kánonov a nejasných čísel“.
Tiež: „Keď sa kombinujú dva prvky, ktoré spôsobujú rôzne zlúčeniny, vzhľadom na pevné množstvo jednej z nich, rôzne množstvá druhého prvku, ktoré sú kombinované s týmto pevným množstvom, ktoré vytvárajú zlúčeniny, sú vo vzťahu k jednoduchým celkovým číslom“.
John Dalton urobil prvý moderný opis atómu ako súčasť chemických prvkov, keď poukázal na to, že prvky sú tvorené nedeliteľnými časticami nazývané atómy.
Okrem toho predpokladal, že zlúčeniny sa tvoria, keď sa atómy rôznych prvkov navzájom kombinujú v rozmeroch jednoduchých celých čísel.
Dalton dokončil výskumné práce Proust's Research Works. Poukázal na existenciu dvoch oxidov cínu s percentuálnymi podielmi 88,1% a 78,7% Tin so zodpovedajúcimi percentuálnymi percentami kyslíka, 11,9% a 21,3%.
-Výpočty
Peroxid vodíka
Ukážte, že vodné zlúčeniny, h2Alebo a peroxid vodíka, h2Ani2, Sú v súlade so zákonom viacerých rozmerov.
Atómové hmotnosti prvkov: H = 1 g/mol a kyslík = 16 g/mol.
Molekulárne pesos zlúčenín: H2O = 18 g/mol a h2Ani2 = 34 g/mol.
Vodík je prvok s pevným množstvom v h2Alebo h2Ani2, Takže proporcie medzi O a H sa stanovia v oboch zlúčeninách.
O/H pomer v H2O = (16 g/mol)/(2 g/mol)
= 8/1
O/H pomer v H2Ani2 = (32 g/mol)/(2 g/mol)
= 16/1
Vzťah medzi oboma pomermi = (16/1)/(8/1)
= 2
Potom je pomer OR/h medzi peroxidom vodíka a vodou 2, celé číslo a jednoduché číslo. Preukáže sú dodržiavanie zákona o viacerých rozmeroch.
Oxidy dusíka
Aká kyslíková hmotnosť sa kombinuje s 3,0 g dusíka v a) oxidu dusnatého, NO a B) oxidu dusičného, NO2. Ukážte, že nie a nie2 Sú v súlade so zákonom viacerých rozmerov.
Hmotnosť dusíka = 3 g
Atómové hmotnosti: dusík, 14 g/mol a kyslík, 16 g/mol.
Výpočty
V NO sa atóm N kombinuje s 1 atómom O, takže kyslíková hmota, ktorá sa kombinuje s 3 g dusíka, sa dá vypočítať nasledujúcim prístupom:
G z dusíka · (PA. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3,43 g alebo
V č2, Atóm N je kombinovaný s 2 atómami O, takže hmotnosť kyslíka, ktorá je kombinovaná, je:
g kyslíka = 3 g · (32 g/mol/14 g/mol)
= 6,86 g alebo
Podiel O/ N pri NO = 3,43 g o/ 3 g n
= 1 143
Podiel alebo/n v no2 = 6,86 g o / 3 g n
= 2 282
Hodnota vzťahu medzi pomermi O / N = 2 282 / 1,143
= 2
Potom hodnota vzťahu medzi pomermi alebo/n je 2, celé číslo a jednoduché číslo. Preto je splnený zákon viacerých rozmerov.
Zákon recipročných rozmerov
Tento zákon formulovaný Richterom a Carl F. Wenzel oddelený.
Môže vám slúžiť: Sodík: História, štruktúra, vlastnosti, riziká a použitieNapríklad, ak máte dve zlúčeniny AB a CB, pozoruje sa, že spoločným prvkom je B.
Zákon alebo recipročné proporcie Richtera-Wenzela hovorí, že s vedomím, do akej miery reaguje s B, aby sa dal AB, a koľko C reaguje s B, aby ste dali CB, môžete vypočítať hmotnosť, na ktorú je potrebné reagovať s hmotnosťou c forma ac.
Výsledkom je, že podiel na: C alebo A/C musí byť viacnásobný alebo submultiple A/B alebo C/B. Tento zákon však nie je vždy splnený, najmä ak prvky predstavujú niekoľko oxidačných stavov.
Zo všetkých zákonov o hmotnosti je to možno „najobľúbenejšia“ alebo komplikovanejšia. Ale ak sa analyzuje z matematického hľadiska, bude zrejmé, že pozostáva iba z faktorov konverzie a zrušenia.
-Príklady
Metán
Ak je známe, že 12 g uhlíka reaguje s 32 g kyslíka za vzniku oxidu uhličitého; a že na druhej strane 2 g vodíka reaguje so 16 g kyslíka za vzniku vody, potom sa dá odhadnúť hmotnostné pomery C/O a H/alebo pre CO2 a h2Alebo, respektíve.
Výpočet c/o a h/alebo máte:
C / o = 12g c / 32g alebo
= 3/8
H / o = 2g h / 16g alebo
= 1/8
Kyslík je spoločným prvkom a je potrebné vedieť, koľko uhlíka reaguje s vodíkom na výrobu metánu; To znamená, že chcete vypočítať c/h (alebo h/c). Potom je potrebné urobiť rozdelenie predchádzajúcich rozmerov, aby sa preukázalo, či je reciprocita splnená:
C/h = (c/o)/(h/o)
Všimnite si, že týmto spôsobom je OS zrušený a C/H zostáva:
C/h = (3/8)/(1/8)
= 3
A 3 je 3/8 viacnásobný (3/8 x 8). To znamená, že 3 g C reaguje s 1 g h, aby sa poskytol metán. Ale aby som to mohol porovnať s CO2, Vynásobí sa C/H 4, čo sa rovná 12; To dáva 12 g C, ktoré reaguje so 4 g h na vytvorenie metánu, čo je tiež pravda.
Sulfid horečnatého
Ak je známe, že 24 g horčíka reaguje s 2 g vodíka za vzniku hydridu horčíka; A navyše 32 g síry reaguje s 2 g vodíka za vzniku sírovodíka, prvok spoločného je vodík a chce vypočítať mg/s z mg/h a h/s.
Potom výpočet mg/h a h/s osobitne máte:
Mg / h = 24g mg / 2g h
= 12
H / s = 2g h / 32 g s
= 1/16
Je však vhodné použiť s/h na zrušenie h. Preto sa S/H rovná 16. Urobili sme to, pokračujeme v výpočte mg/s:
Mg/s = (mg/h)/(s/h)
= (12/16)
= 3/4
A 3/4 je submultiple 12 (3/4 x 16). Podiel mg/s naznačuje, že 3 g mg reaguje so 4 g síry za vzniku sulfidu horčíka. Aby ste však dokázali porovnať s mg/h, musíte vynásobiť mg/s o 8. 24 g mg reaguje s 32 g síry, aby sa dal tento kovový sulfid.
Chlorid hliníka
Je známe, že 35,5 g Cl reaguje s 1 g h na vytvorenie HCl. Tiež 27 g Al reaguje s 3 g h na vytvorenie alh3. Vypočítajte podiel chloridu hliníka a povedzte, že ak sa takáto zlúčenina poslúcha Richtera-Wenzelovho zákona.
Opäť sa Cl/H a AT/H vypočítajú osobitne:
Cl / h = 35,5 g cl / 1g h
= 35,5
At/ h = 27 g at/ 3g h
= 9
Teraz sa vypočíta na/cl:
At/cl = (al/h)/(cl/h)
= 9/35,5
≈ 0,250 alebo 1/4 (v skutočnosti je 0,253)
To znamená, 0,250 g Al reaguje s 1 g Cl, aby sa vytvorila zodpovedajúca soľ. Ale opäť sa musí vynásobiť na/cl číslom, ktoré umožňuje jeho porovnanie (pre pohodlie) s al/h.
Implikovanie pri výpočte
Potom sa vynásobí na/cl o 108 (0,27/250), čo dáva 27 g, z ktorého reaguje so 108 g Cl. To sa nestane presne tak. Ak vezmeme napríklad hodnotu 0,253 podľa AL/CL a vynásobíme ju 106,7 (27/0,253), 27 g AL reaguje so 106,7 g Cl; Čo sa blíži viac k realite (Alcl3, s PA 35,5 g/mol pre CL).
Tu sa pozoruje, ako môže Richterov zákon začať staggovať kvôli presnosti a zneužívaniu desatinných miest.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Kvety, J. Chémia (2002). Redakcia Santillana.
- Joaquín San Frutos Fernández. (s.F.). Hmotnosť a objemové zákony. Získané z: Encina.pnent.Mec.je
- Tobolka. (s.F.). Zákony chemickej kombinácie. Získané z: Toppr.com
- Brilantný. (2019). Zákony chemickej kombinácie. Zotavené z: brilantného.orgán
- Chémia librettexts. (15. júla 2015). Základné chemické zákony. Získané z: Chem.Librettexts.orgán
- HelMestine, Anne Marie, PH.D. (18. januára 2019). Zákon o zachovaní omše. Zotavené z: Thoughtco.com

