Aký je najviac elektronegatívny prvok a prečo?

- 3247
- 419
- Alfréd Blaho
 Najviac elektronegatívnym prvkom je fluorid (F), uzamknutý v červenom kruhu
Najviac elektronegatívnym prvkom je fluorid (F), uzamknutý v červenom kruhu On Viac elektronegatívneho prvku V periodickej tabuľke je to fluór, ktorého chemikália je f a patrí do halogénovej skupiny. Spomedzi všetkých prvkov periodickej tabuľky je fluorid najviac znepokojený zachytením elektrónov z iných atómov.
Tento prvok, plynný pri izbovej teplote, je vysoko reaktívny, a preto ho nie je ľahké nájsť ho v čistom stave v prírode. Fluór sa ľahko spája s inými prvkami, ako je síra, vápnik a kovy, ako aj množstvo zlúčenín, najmä tie, ktoré obsahujú vodík.
Jeho vysoká elektronegativita vám umožňuje dokonca kombinovať s ušľachtilými plynmi, ako sú Xenon, Kripton a Radon.
Po fluóru je kyslík druhým prvkom s najvyššou elektronegativitou. Naopak, prvky s najnižšou elektronegativitou sú Francio (FR) a Cézium (CS).
 Pretože je to najviac elektronegatívny prvok, fluór tvorí početné zlúčeniny, ako je fluorit alebo fluorid vápenatý. Zdroj: Wikimedia Commons
Pretože je to najviac elektronegatívny prvok, fluór tvorí početné zlúčeniny, ako je fluorit alebo fluorid vápenatý. Zdroj: Wikimedia Commons To sú preto najviac elektropozitívny to existuje, hoci Francio je rádioaktívny a veľmi málo hojný charakter.
Elektronegativita a periodická tabuľka
Stupnica elektronegativity vyvinula chemik a cena Nobel Linus Pauling (1901-1994), hoci tento koncept je spôsobený švédskym chemikom Jönsom Jakobom Berzeliom (1779-1848).
Paulingova stupnica, ktorá priraďuje rozmerové numerické hodnoty k elektronegativite, sa používa na meranie intenzity, s ktorou atóm priťahuje elektrón iného iného atómu, a teda vytvára spojenie.
Každý prvok má svoju vlastnú elektronegativitu, ktorá závisí od jeho atómových vlastností. Experimentálne a nepriamo sa určuje, napríklad meranie energie spojenia, ako to urobil Pauling okolo roku 1932.
Na stupnici Pauling Electronegativity je fluorid prvý, s približnou hodnotou 3.98 ≈ 4.0.
Môže vám slúžiť: alifatické uhľovodíky: Vlastnosti, nomenklatúra, reakcie, typyElektronegativita je periodická vlastnosť prvkov. Vo väčšine prípadov (existujú určité výnimky) sa zistilo, že elektronegativita sa zvyšuje pri prechode zľava doprava v radoch periodickej tabuľky.
A tiež sa zvýšiť zdola nahor, presunutím na stĺp.
 Periodická tabuľka elektronegativity podľa Paulingovej stupnice. Fluór je najviac elektronegatívny prvok, ktorý sa nachádza nad a vpravo, zatiaľ čo Francio je najmenej elektronegatívnym zo všetkých alebo najviac elektroozitívnych, ak je preferovaný a je v ľavom a nadolovom stĺpci. Zdroj: f. Zapata.
Periodická tabuľka elektronegativity podľa Paulingovej stupnice. Fluór je najviac elektronegatívny prvok, ktorý sa nachádza nad a vpravo, zatiaľ čo Francio je najmenej elektronegatívnym zo všetkých alebo najviac elektroozitívnych, ak je preferovaný a je v ľavom a nadolovom stĺpci. Zdroj: f. Zapata. Elektronegativita fluóru
Dôvod, prečo je fluór najviac elektronegatívnym prvkom v periodickej tabuľke, je spôsobený jeho elektronickou konfiguráciou (spôsob, akým sú jeho elektróny usporiadané v orbitáloch okolo jadra).
Táto konfigurácia je 1s22s22 P5, Fluorid má teda 5 elektrónov vo svojej vonkajšej vrstve.
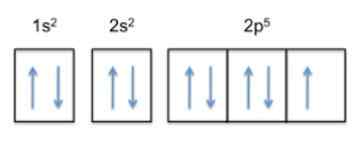
Teraz, keďže trend atómu je dokončiť svoju vonkajšiu vrstvu, znamená to, že fluór prijme elektrón iných atómov s veľkou ľahkosťou, aby sa získal stabilitu a podobal sa ušľachtilému plynu toho istého radu, čo je neón , ktorého elektronická konfigurácia je 1s22s22 P6.
Atóm fluóru má veľmi malý polomer, pretože protóny v ich jadre priťahujú elektróny veľmi silne a udržiavajú ich bližšie ako v atómoch menších elektronegatívnych prvkov, ako je Cessium a Francio.
Preto sú títo ochotní ľahko sa vzdať elektrónov, aby vytvorili odkazy.
Odkazy
- Aguilar, C. Sprievodca pre jednotku chemického vzdelávania I. Zdroj: IPN.mx.
- Atkins, str. (2005). Princípy chémie, cesty objavovania. Tretí. Vydanie. PAN -AMERICKÝ ZDROJE.
- Clark, J. ElektroneGivity. Získané z: Chem.Librettexts.orgán.
- Hein, m. (2014). Nadácie chémie vysokej školy. 14. vydanie. Mravný.
- Šošovica. Chemické prvky objednané podľa jej elektronegativity. Získané z: Lentech.je.

