Chemická väzba
- 2794
- 19
- Mgr. Pravoslav Mokroš
Vysvetlíme, aké sú chemické odkazy, typy, ktoré existujú, a uvádzame veľa príkladov
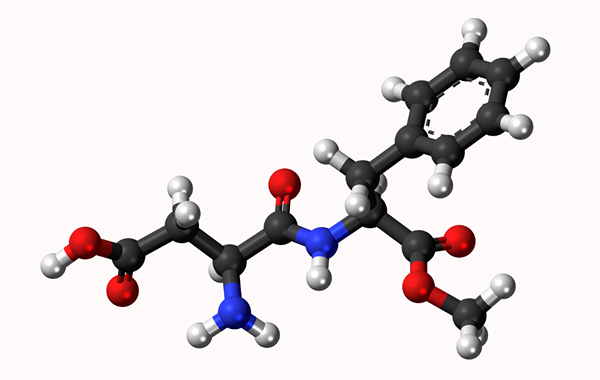
 Molekulárny model Aspartamo: Jednoduché spojenie predstavované riadkom a dvojitou väzbou o dva riadky. Gule sú atómy
Molekulárny model Aspartamo: Jednoduché spojenie predstavované riadkom a dvojitou väzbou o dva riadky. Gule sú atómy Čo je to chemická väzba?
A Chemická väzba Je to sila, ktorá drží spolu s atómami zlúčeniny. Sila, ktorá spája atómy, je elektromagnetická a keď sú atómy viazané, zachovávajú si svoju vlastnú povahu.
Napríklad spoločná voda sa tvorí v dôsledku spojenia dvoch atómov vodíka (H2) a jeden z kyslíka (O); Preto je jeho chemický vzorec h2Ani. Aj keď sú zjednotené na tvorbu vody, atómy vodíka zostávajú vodíkom a kyslík je stále kyslík.
Pripomeňme, že atómy sú tvorené jadrom obklopeným oblakom elektrónov, ktoré majú záporné zaťaženie. Jadro atómu má pozitívny náboj, ktorý sa podarí prilákať elektróny.
Elektróny sa však priťahujú aj k jadrám iných atómov. Takto sa vytvárajú chemické odkazy. Skutočnosť, že atómy poskytujú alebo zdieľajú elektróny, vytvára rôzne typy chemických väzieb.
V chemických väzbách sa atómy výťažok, výnos, výhra alebo zdieľanie elektrónov toho, čo sa nazýva vrstva Valencia, ktorá je najvzdialenejšou vrstvou atómu, kde sa vyskytuje reaktivita alebo tendencia tvoriť chemické väzby.
Tieto odkazy vytvárajú nové látky (nie zmesi), ktoré sa nedajú oddeliť technikami, ako je sito alebo filtrovanie.
Chemické väzby
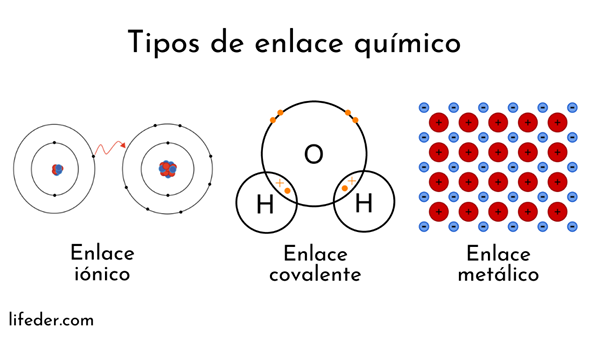
Atómy sú tvorené jadrom (s kladným elektrickým nábojom) a elektrónmi (častice s negatívnym elektrickým nábojom), ktoré sa točia okolo. Obe strany zasahujú do chemických väzieb.
Chemické väzby zahŕňajúce atómové jadrá sa nazývajú kovové. Na druhej strane, tí, ktorí sa týkajú výmeny elektrónov, sú rozdelené na ióny a kovalent.
Môže vám slúžiť: chlórbenzén (C6H5Cl)Iónové odkazy
Tento typ spojenia je veľmi odolný; produkuje tuhé chemické zlúčeniny (kryštály) vo vode a s vysokým bodom topenia (medzi 300 a 1.000 stupňov Celzia). Rozpustené vo vode, sú to elektrické vodiče.
Ako sú iónové odkazy?

Vyskytujú sa iónové väzby medzi kovom a net -kmetom, ktoré majú inú elektronegativitu (schopnosť prilákať elektróny). Elektróny vrstvy Valencie jedného atómu prechádzajú na druhý atóm Valencie. Čo je rovnaké; Kovový atóm dáva elektrón nemetalickému atómu, ktorý dosahuje elektronickú stabilitu.
V priebehu celého procesu formovania odkazov sa vytvárajú ióny (katióny a anióny), teda názov iónového dlhopisu.
Príkladom tohto typu väzby je chlorid sodný: táto chemická zlúčenina sa tvorí, keď chlór (CL) priťahuje elektrón valenčnej vrstvy, ktorý má atóm sodíka (NA).
Ďalším príkladom je chlorid mangánu (MGC), ktorý sa používa pri výrobe obrazov a dezinfekčných prostriedkov. V dôsledku chemickej väzby sú elektróny atómu mangánu absorbované atómom chlóru.
Kovalentné odkazy
Kovalentné väzby sú veľmi tvrdé a vytvárajú nerozpustné chemické zlúčeniny s vysokou fúznou teplotou (viac ako 1.000 stupňov Celzia). Nesprávajú elektrinu.
Podľa spôsobu, akým atómy zdieľajú svoje elektróny, môžu byť kovalentné väzby:
- Jednoduchý: Zdieľajú pár elektrónov (A-A).
- Zdvojnásobiť: Zdieľajte dva páry elektrónov (a =).
- Trojnásobok: Zdieľajte tri páry elektrónov (A≡A).
Ako sa tvoria kovalentné väzby?

Kovalentná väzba sa tvorí, keď dva nemetalické prvky zdieľajú elektróny svojej valenčnej vrstvy.
Môže vám slúžiť: Rubidio: História, vlastnosti, štruktúra, získavanie, použitie, použitiaVýmena elektrónov sa vždy vyskytuje takým spôsobom, že je v súlade s oktetovým zákonom. Toto je chemický princíp, ktorý uvádza, že najstabilnejšia konfigurácia atómu je taká, v ktorej má vo svojej vonkajšej vrstve osem elektrónov.
Príkladom kovalentnej väzby je voda (h2Buď). Na vytvorenie molekuly vody sú potrebné dve jednoduché kovalentné väzby. V jednoduchej väzbe je vodíkový elektrón zdieľaný s kyslíkom a kyslík zdieľa elektrón s vodíkom.
Ďalším príkladom kovalentnej väzby je oxid uhličitý (CO2), jeden z hlavných zodpovedných za skleníkový efekt a zmenu podnebia. Aby sa vytvorila táto zlúčenina, uhlík a kyslík vytvárajú dve dvojité väzby, to znamená pre každé zdieľanie dvoch párov elektrónov.
Kovové odkazy
Tento typ odkazu sa deje iba v kovových prvkoch. Skladá sa z spojenia jadier dvoch atómov toho istého kovového prvku spolu s ich elektrónmi.
Kovové spojenia sa vyznačujú tým, že sú účinnými vodičmi elektriny, majú veľmi vysoký bod fúzie a varu a ľahko oxidované. Sú tiež poddajné a odolné voči poškriabaniu, veľmi pevné a silné.
Ako sa majú kovové odkazy?
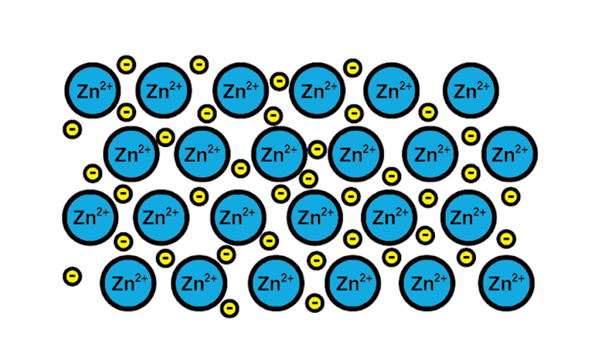 Kovový odkaz zinku
Kovový odkaz zinku Príkladom kovového spojenia je zinok, kovový prvok. Proces tréningu tohto typu odkazu je:
1-a atómové jadro kovového prvku spĺňa ďalšie jadro toho istého prvku.
2-Elektróny vrstvy valencie oboch jadier sa stávajú morom elektrónov okolo. To znamená, že neobiehajú jediné atómové jadro.
3-Pozitívne zaťaženie atómových jadier a negatívy elektrónov sú priťahované. Výsledkom sú valenčné elektróny, ktoré tvoria more elektrónov okolo atómových jadier (katióny).
Môže vám slúžiť: sulfát meďnatého (CUSO4): Štruktúra, vlastnosti, získanie, použitiaPríklady chemickej väzby
Iónové odkazy
- Oxid bárnatého (BAO).
- Chlorid horečnatý (MGCL2).
- Oxid vápenatý (CAO)
- Dusičnan strieborný (agno3)
- Zinkový hydroxid (Znoh2)
- Bromid draselný (KBR)
- Uhličitan vápenatý (Caco3)
- Sulfát medi (CUO4)
- Fluorid lítia (LIF)
- Chlorid mangánu (MNCL2)
- Síran draselný (k2SW4)
- Oxid železa (škaredý)
- Fosforečnan (NA2HPO4)
- Ioduro draselný (KI)
Kovalentné odkazy
- Oxid uhličitý (CO2)
- Amoniak (NH3)
- Parafín (CNH2N+2)
- Nafta (c12H26)
- Dibromo (BR2)
- Oxid uhoľnatý (CO)
- Butano (c4H10)
- Benzén (c6H6)
- Molekulárny dusík (n2)
- Metán (CH4)
- Kyselina chlorovodíková (HCL)
- Kyselina cyanhydrová (HCN)
Kovové odkazy
Akýkoľvek kov v jeho čistom stave je príkladom kovového spojenia, konkrétne:
- Nikel (ni)
- Železo (viera)
- Hliník (AL)
- Titán (Ti)
- Olovo (PB)
- Kobalt (CO)
- Meď (Cu)
- Zinok (Zn)
- Ortuť (HG)
- Zlato (Au)
- Striebro (AG)
- Bária (BA)
Dôležitosť chemických väzieb
Dôležitosť chemických väzieb spočíva v tom, že tvoria organické a anorganické molekuly, a týmto spôsobom sú súčasťou základne všetkých živých organizmov. Ak sú vystavené určitým podmienkam, tieto odkazy sa dajú porušiť. Táto energia sa volá Prepojiť energiu.
Niektoré z techník na prelomenie spojení sa aplikujú elektrinou, vysokými teplotami alebo provokovaním chemických reakcií s rôznymi zlúčeninami.
Napríklad na oddelenie molekúl kyslíka a vodíka od H2Alebo môžeme aplikovať elektrinu na vodu, ktorá je procesom známy ako elektrolýza.
Chemické zlúčeniny tvorené Linkom sú početné a sú prítomné v každodennom živote. Soľ, ktorú používame na sezvoky potravín, je chemický zlúčenina spojenia medzi atómom sodíka (NA) a jedným chlórom (CL) (CL). Jeho chemický vzorec je NaCl, ktorý číta chlorid sodný.

