Konštanty antoínových vzorcov, rovníc, príkladov
- 1902
- 467
- Alan Milota
Ten konštanty antoínu Existujú tri parametre, ktoré sa objavujú v empirickom vzťahu medzi tlakom saturačnej pary a teplotou pre čisté látky. Závisia od každej látky a majú byť konštantné v určitom rozsahu teplôt.
Z tohto rozsahu konštanty antoínu menia svoju hodnotu. Konštanty sú spojené prostredníctvom rovnice vytvorenej v roku 1888 francúzsky inžinier Louis Charles Antoine (1825-1897).
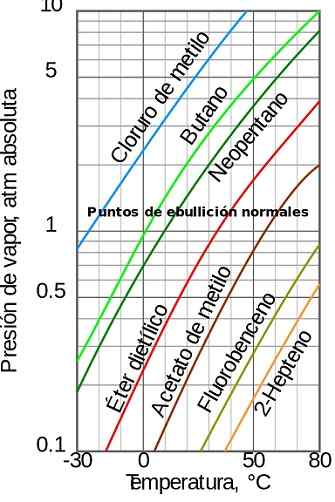
 postava 1. Tlak pary v závislosti od teploty. Zdroj: Wikimedia Commons
postava 1. Tlak pary v závislosti od teploty. Zdroj: Wikimedia Commons [TOC]
Vzorce a rovnice
Najbežnejším spôsobom vyjadrenia Antoineho funkcie je:

V tomto vzorci p predstavuje tlak nasýtenej pary vyjadreným v milimetroch ortuti (MMHG), t je teplota, ktorá je nezávislou premennou a je vyjadrená v ℃.
A, B a C sú konštanty alebo parametre antoínového vzorca.
Dôležitosť tohto vzorca, ktorý napriek tomu, že je empirický, poskytuje jednoduchý analytický výraz, ktorý sa dá ľahko použiť v termodynamických výpočtoch.
Antoineov vzorec nie je jedinečný, existujú presnejšie výrazy, ktoré sú rozšírením tohto vzorca, ale s nevýhodou, ktoré majú šesť alebo viac parametrov a ich matematický výraz je zložitejší, čo z nich robí veľmi praktiky, ktoré sa majú použiť v termodynamických výpočtoch.
Nasýtenie
Keďže Antoineho vzorec meria tlak nasýtenia pary, je potrebné vysvetliť, z čoho pozostáva.
V sklenenej ampoule alebo inej nádobe je umiestnená tekutina. Všetok vzduchový vzduch sa získava. Sada sa umiestni do tepelného kúpeľa, kým sa rovnováha nedosiahne.
Na začiatku je všetko tekuté, ale pretože existuje vákuum, najrýchlejšie molekuly začínajú opúšťať kvapalinu tvoriacu plyn rovnakej látky kvapaliny.
Môže vám slúžiť: Rovnomerný priamy pohyb: Charakteristiky, vzorce, cvičeniaPredchádzajúci proces je odparovanie A ako sa zvyšuje tlak pary.
Niektoré molekuly pary strácajú energiu a vrátia sa do kvapalnej fázy látky, je to proces kondenzácia.
Potom sa vyskytujú dva procesy, odparovanie a kondenzácia súčasne. Keď vyjde rovnaký počet kvapalných molekúl, ktoré sú do nich začlenené, a dynamická rovnováha A v tomto okamihu dochádza k maximálnemu tlaku pary známeho ako saturačný tlak.
Práve tento tlak na nasýtenie pary predpovedá antoínové vzorec pre každú látku a každú teplotu.
V niektorých tuhých látkach je podobný jav, keď prechádza z tuhej fázy do sódy priamo bez toho, aby prešiel kvapalnou fázou, v týchto prípadoch sa môže merať aj tlak nasýtenia pary.
Nie je ľahké stanoviť teoretický model začínajúci od skorých princípov, pretože sú zapojené zmeny v molekulárnej kinetickej energii, ktoré môžu byť translačného, rotačného a vibračného typu, s energiou vnútornej molekulárnej väzby. Z tohto dôvodu sa v praxi používajú empirické vzorce.
Aká je konštanta antoínu?
Neexistuje žiadna teoretická metóda na získanie konštánt antoínu, pretože ide o empirický vzťah.
Získajú sa z experimentálnych údajov každej látky a úpravy troch parametrov A, B a C, takže minimalizujú kvadratický rozdiel (metóda štvorcových minimá) predikcie s experimentálnymi údajmi.
Pre koncového používateľa, ktorí sú vo všeobecnosti chemickými inžiniermi, sú v chemických príručkách tabuľky, v ktorých sú tieto konštanty dané pre každú látku, čo naznačuje maximálne a minimálne teplotné rozsahy, v ktorých sú použiteľné.
Môže vám slúžiť: Odpor teplomer: Charakteristiky, prevádzka, použitieK dispozícii sú aj online služby, ktoré poskytujú hodnoty konštánt A, B a C, ako je to v prípade služieb DDBST GMBH OnLines Services.
Pre tú istú látku môže existovať viac ako jedna teplota platnosti. Potom je zvolená jedna alebo druhá skupina konštánt v závislosti od pracovného rozsahu.
Ťažkosti sa môžu objaviť, ak sa teplotný pracovný rozsah je medzi dvoma rozsahmi platnosti konštánt, pretože predpovede tlaku vzorca sa nezhodujú v hraničnej zóne.
Príklady
Príklad 1
Nájdite tlak vodnej pary pri 25 ℃.
Riešenie
Konzultovali sme s tabuľkami, aby sme určili konštanty antoínu.
Existujú dva rozsahy vody:
Medzi 1 ℃ a 100 ℃ a medzi 99 ℃ až 374 ℃.
Keďže sa zaujímame o 25 ℃, berieme prvý rozsah, v ktorom sú hodnota Antoineho konštánt:
A = 8,07131
B = 1730,63
C = 233 426
P = 10^(8 07131 - 1730,63/(25 + 233 426))
Výpočet exponentu
Vypočítajme exponent najskôr: 1 374499
P = 10^1 374499 = 23 686 mmHg = 0,031166 ATM
Analýza výsledkov
Tieto výsledky sa interpretujú takto:
Predpokladajme, že čistá voda je umiestnená do hermetickej nádoby, do ktorej bol vzduch extrahovaný vákuovým čerpadlom.
Nádoba s vodou sa umiestni do tepelného kúpeľa pri teplote 25 ℃, kým tepelná rovnováha nedosiahne.
Voda v hermetickej nádobe sa čiastočne odparí, až kým sa nedosiahne tlak nasýtenia, čo nie je nič iné ako tlak, pri ktorom sa stanoví dynamická rovnováha medzi kvapalnou fázou vody a fázou pary.
Môže vám slúžiť: Dirac Jordan Atomic Model: Charakteristiky a postulátyTento tlak sa v tomto prípade ukázal na 0,031166 atm pri 25 ℃.
Príklad 2
Nájdite tlak vodnej pary pri 100 ℃.
Riešenie
Konzultovali sme s tabuľkami, aby sme určili konštanty antoínu. Existujú dva rozsahy vody:
Medzi 1 ℃ a 100 ℃ a medzi 99 ℃ až 374 ℃.
V tomto prípade je teplota záujmu v týchto dvoch rozsahoch.
Používame prvý z rozsahov [1 ℃, 100 ℃]
A = 8,07131
B = 1730,63
C = 233 426
P = 10^(8 07131 - 1730,63/(100 + 233 426))
Výpočet exponentu
Najprv vypočítame exponent: 2.8808
P = 10^1 374499 = 760,09 mmHg = 1 0001 bankomatu
Ďalej používame druhý z rozsahov [99 ℃, 374 ℃]
V tomto prípade sú konštanty
A = 8 14019
B = 1810.94
C = 244.485
P = 10^(8.14019 - 1810.94/(100 + 244.485))
Najprv vypočítame exponent: 2.88324
P = 10^2.88324 = 764.2602 mmHg = 1 0056 bankomatu
Medzi dvoma výsledkami 0,55% je percentuálny rozdiel.
Odkazy
- Uplatňovanie zákonov Raoulta a Daltona a Antoine rovnice. Zdroj: môj vlastný a starodávny.Slovník.com
- Online kalkulačka antoínového vzorca. Obnovené z: Ddbonline.Ddbst./antoinecalcion/antoinecalculaticgi.exe
- Gecousb. Termodynamika a parné tabuľky / konštanta z antoínu. Získané z: gecousb.com.ísť
- Tepelné vlastnosti hmoty. Obnovený z: webového servera.DMT.Uhorka.je
- Výhľad a jang. Antoínové konštantné tabuľky pre viac ako 700 organických zlúčenín. Obnovené z: používateľa.Breh.Umd.Edu
- Wikipedia. Antoínová rovnica. Zotavené z Wikipédie.com
- Wikipedia. Clausius-Clapeyronova rovnica. Zotavené z Wikipédie.com
- Wisniak J. Historický vývoj rovnice tlaku pary od Dalton Toy Antoine. Obnovené z: link.Prubár.com
- « Výpočet relatívnej hustoty, príklady, cvičenia
- Náladové rovnice diagramu, na čo je to, aplikácie »

