Konštrukcia elektronickej konfigurácie jadra, príklady
- 4174
- 766
- Tomáš Mydlo
Ten Elektronická konfigurácia jadra Alebo kompaktné je, že ktorých kvantové zápisy z počtu elektrónov a ich energetických čiastkových stupňov sú skrátené symbolmi ušľachtilých plynov v štvorcových držiakoch. Je to veľmi užitočné pri písaní elektronických konfigurácií pre určitý prvok, pretože je jednoduché a rýchle.
Slovo „jadro“ sa zvyčajne vzťahuje na elektronické vnútorné vrstvy atómu; To znamená, že ich elektróny nie sú z Valencie, a preto sa nezúčastňujú chemickej väzby, hoci definujú vlastnosti prvku. Metaforicky povedané, jadro by bolo interiérom cibule, pričom jeho vrstvy sa skladali zo série rastúcich orbitálov v energii.
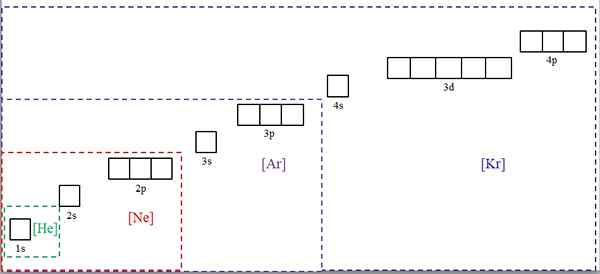
 Elektronické konfigurácie skrátene so symbolmi ušľachtilých plynov. Zdroj: Gabriel Bolívar.
Elektronické konfigurácie skrátene so symbolmi ušľachtilých plynov. Zdroj: Gabriel Bolívar. Vynikajúci obraz ukazuje chemické symboly pre štyri ušľachtilé plyny v štvorcových držiakoch a s rôznymi farbami: [He] (zelený), [NE] (červený), [ar] (fialová) a [KR] (modrá) (modrá).
Každý z jeho bodkovaných rámcov obsahuje škatule, ktoré predstavujú orbitály. Čím väčší, tým väčší je počet obsahujúcich elektróny; čo bude zase znamenať, že elektronické konfigurácie viacerých prvkov sa dajú zjednodušiť týmito symbolmi. To šetrí čas a energiu písaním všetkých zápisov.
[TOC]
Stavebný poriadok
Pred použitím elektronických konfigurácií jadra je vhodné skontrolovať správne poradie na zostavenie alebo zápis týchto konfigurácií. Toto sa riadi podľa diagonálneho pravidla alebo diagramu Moeller (nazývané v niektorých častiach dažďa). Kvantové zápisy, ktoré majú po ruke, zostávajú nasledujúce:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Môže vám slúžiť: Základné soli: vzorec, vlastnosti, nomenklatúra, príkladyTento rad kvantových zápisov vyzerá vyčerpaný; A bolo by to ešte viac, keby ste to museli napísať stále, aby ste boli reprezentovaní elektronická konfigurácia akéhokoľvek prvku, ktorý sa našiel v období 5. Všimnite si, že riadok je prázdny elektrónmi; Neexistujú žiadne čísla pri vyšších práv na práva (1S22s22 P6…).
Malo by sa pamätať na to, že orbitály siež môže „hosťovať“ dva elektróny (ns2). Orbitáli p Celkom sú tri (pozrite sa na tri boxy vyššie), takže môžu hostiť šesť elektrónov (NP6). A nakoniec orbitály d Je päť a F sedem, má celkom desať (nd10) a štrnásť (nf14) elektróny, respektíve.
Skratka elektronickej konfigurácie
To znamená, že predný rad kvantových zápisov je naplnený elektrónmi:
1s2 2s2 2 P6 3s2 3p6 4s2 3D10 4p6 5s2 4d10 5 P6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Koľko elektrónov je celkovo? 118. A ktorý prvok zodpovedá takým obrovským množstvom elektrónov v jeho atóme? Do vznešeného oganinského plynu, OG.
Predpokladajme, že existuje prvok s kvantovým číslom z rovnajúcim sa 119. Potom by jej elektronická konfigurácia Valencia bola 8s1; Ale aká by bola jej úplná elektronická konfigurácia?
1s2 2s2 2 P6 3s2 3p6 4s2 3D10 4p6 5s2 4d10 5 P6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6 8s1
A čo by bola vaša elektronická konfigurácia jadra, kompaktný? Toto:
[OG] 8s1
Všimnite si zjavné zjednodušenie alebo skratku. V symbole [OG] všetkých vyššie uvedených 118 elektrónov je spočítaných, takže tento neistý prvok má 119 elektrónov, z ktorých iba jeden pochádza z Valencie (v periodickej tabuľke by sa nachádzal pod Francúzom).
Môže vám slúžiť: čo je nasýtené roztok? (S príkladmi)Príklady
Všeobecný
Predpokladajme, že teraz chcete postupne vykonávať skratku:
[On] 2s2 2 P6 3s2 3p6 4s2 3D10 4p6 5s2 4d10 5 P6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Všimnite si, že 1S2 Nahradil to [on]. Ďalším šľachtickým plynom je neón, ktorý má 10 elektrónov. Vedieť to, skratka pokračuje:
[Ne] 3s2 3p6 4s2 3D10 4p6 5s2 4d10 5 P6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Potom sledujte argón s 18 elektrónmi:
[Ar] 4s2 3D10 4p6 5s2 4d10 5 P6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Pretože ďalším šľachtickým plynom je Kripton, ďalších 36 elektrónov je pokročilých:
[KR] 5S2 4d10 5 P6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Xenón má 54 elektrónov, a preto presunieme skratku na orbitál 5p:
[Xe] 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
V tomto bode je elektronická konfigurácia vždy skrátená na orbitál NP; To znamená, že ušľachtilé plyny majú tieto orbitály plné elektrónov. A nakoniec sledujte radón s 86 elektrónmi, takže skrátime orbitál 6p:
[Rn] 7s2 5f14 6d10 7p6
Kyslík
Kyslík má osem elektrónov, čo je úplná elektronická konfigurácia:
1s22s22 P4
Jediná skratka, ktorú môžeme použiť, je [on] o 1s2. Jeho elektronická konfigurácia jadra je:
[On] 2s22 P4
Draslík
Draslík má devätnásť elektrónov, čo je úplnou elektronickou konfiguráciou:
Môže vám slúžiť: Odkiaľ pochádza plast? História1s2 2s2 2 P6 3s2 3p6 4s1
Všimnite si, že symbol môžeme použiť na skrátenie tejto konfigurácie; ako aj [ne] a [ar]. Posledne menovaný sa používa, pretože argón je ušľachtilý plyn, ktorý ho predchádza najbližšie k draslíku. Preto jej elektronická konfigurácia jadra zostáva:
[Ar] 4s1
Indický
Ind má štyridsať -vinné elektróny, čo je úplnou elektronickou konfiguráciou:
1s2 2s2 2 P6 3s2 3p6 4s2 3D10 4p6 5s2 4d10 5 P1
Pretože Kripton je najbližší šľachtický plyn, ktorý predchádza Indiánu, používa sa symbol [KR] pre skratku a jeho elektronická konfigurácia jadra je:
[KR] 5S2 4d10 5 P1
Aj keď 4D orbitály formálne nepatrí do indického jadra, ich elektróny nezasahujú do kovovej väzby (aspoň za normálnych podmienok), ale v orbitáloch 5S a 5p.
Volfrám
Volfrám (alebo Wolframio) má 74 elektrónov a jeho úplná elektronická konfigurácia je:
1s2 2s2 2 P6 3s2 3p6 4s2 3D10 4p6 5s2 4d10 5 P6 6s2 4f14 5 D4
Opäť hľadáme najbližší šľachtický plyn. V jeho prípade zodpovedá Xenón, ktorý má úplné orbitály 5p. Preto nahradíme rad kvantových zápisov symbolom [XE] a nakoniec budeme mať svoju elektronickú konfiguráciu jadra:
[Xe] 6s2 4f14 5 D4
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Thayer. (2016). Elektrónové konfiguračné diagramy. Získané z: ChemistryApp.orgán
- HelMestine, Anne Marie, PH.D. (5. decembra 2018). Definícia jadra vznešeného plynu. Zotavené z: Thoughtco.com/ com/
- Wikipedia. (2019). Elektronická konfigurácia. Obnovené z: je.Wikipedia.orgán
- « História diskotéky uránu a speváci, ktorí ju vyhrali
- Tuskegee Experiment História, motívy a kritika »

