Chemická koncentrácia

- 3619
- 962
- MUDr. Žigmund Boška
 Chemická koncentrácia je to, čo určuje podiel rozpustenej látky a rozpúšťadla v chemickom roztoku
Chemická koncentrácia je to, čo určuje podiel rozpustenej látky a rozpúšťadla v chemickom roztoku Čo je chemická koncentrácia?
Ten Chemická koncentrácia Je to vlastnosť riešení, ktorá predstavuje množstvo rozpustenej jednotky pre každú jednotku riešenia. Inými slovami, je to číslo, ktoré označuje pomer, v ktorom sa nachádzajú rozpustení a rozpúšťadlo.
Pripomeňme, že roztok je homogénna zmes tvorená rozpúšťadlom (všeobecne kvapalina) a jedna alebo viac látok rozpustených v rozpúšťadle, ktoré nazývame rozpustené látky. Roztoky sa vyznačujú rozpúšťadlom, rozpustenou látkou a koncentráciou.
Koncentrácia je veľmi užitočná vlastnosť vlastníctva, pretože nám umožňuje opísať ich. Napríklad, ak vieme, že koncentrácia soli v morskej vode je 35 gramov pre každý liter, potom vieme, že v našom dome rozpúšťame 35 gramov soli v liter roztoku, získame rovnaké riešenie slaného morskej vody.
Charakteristiky chemickej koncentrácie
Je to intenzívny majetok
Toto je hlavná charakteristika koncentrácie. Intenzívne znamená, že nezávisí od množstva riešenia, ktoré máme. Ako príklad to znamená, že koncentrácia je rovnaká v kvapke morskej vody ako v 100 litroch toho istého.
Môže sa líšiť v závislosti od teploty
Všeobecne sa pri zahrievaní rozširujú alebo zvyšujú svoj objem. To platí aj pre riešenia. Z tohto dôvodu sa koncentrácie vyjadrené v závislosti od objemu môžu pri zahrievaní alebo ochladení roztoku mierne zmeniť.
Môže pokrývať veľmi široké rozsahy rozsahov
Bez ohľadu na jednotky, v ktorých je exprimovaná chemická koncentrácia, môže mať od relatívne veľkých hodnôt až po extrémne malé hodnoty.
Napríklad koncentrácia roztoku vyjadreného v percentách môže mať hodnoty od 0% do 100%, čím pokrýva veľa rád. Mohli by sme pripraviť 90%roztok, pretože by sme mohli tiež pripraviť jeden do 10-12%, čo je takmer 14 objednávok menšej veľkosti.
Čo je chemická koncentrácia pre?
Poznanie koncentrácie roztoku nám umožňuje opísať ho. Existuje veľa vlastností roztokov, ktoré závisia od ich koncentrácie. Napríklad bod topenia a varu závisí od koncentrácie, takže viem, že nám umožňuje vypočítať tieto dve vlastnosti.
Môže vám slúžiť: sklovecNa druhej strane koncentrácia nám umožňuje ľahko porovnať roztok s iným. Ak máme dve vodné roztoky s cukrom, vedenie, že ich koncentrácie nám umožní vedieť, ktorá z nich je sladšia.
Okrem toho všetky chemické reakcie, ktoré umožňujú život, silne závisia od koncentrácie nekonečných rozpustených látok v bunkách a okolie živých bytostí.
Napríklad koncentrácia kyslíka vo vzduchu určuje, či sa osoba bude dusiť alebo nie; PH roztoku (čo je spôsob, ako merať koncentráciu H iónov+) Určite, či budú baktérie žiť a reprodukovať, alebo či naopak zomrie; a koncentrácia jedu určí, či bude smrteľný alebo nie.
Typy koncentračných jednotiek
Koncentrácia roztoku je jedna, takže nie je správne hovoriť o typoch koncentrácie. Rovnaká koncentrácia však môže byť vyjadrená v rôznych typoch koncentračných jednotiek. Toto sú:
- Jednotky fyzickej koncentrácie
- Chemické koncentračné jednotky
Jednotky fyzickej koncentrácie
Tieto sa vyznačujú vyjadrením množstiev rozpustenej látky a rozpúšťadla buď v jednotkách hmotnosti alebo objemu. Nazývajú sa fyzické jednotky, pretože sú spojené s hmotnosťami a objemami namiesto krtkov a ekvivalentných.
Keď porovnávame dve roztoky, ktoré majú rovnakú fyzickú koncentráciu, nemôžeme zabezpečiť, aby mali rovnaké množstvá atómov a molekúl. To ich odlišuje od jednotiek chemickej koncentrácie.
Najbežnejšie fyzické jednotky koncentrácie sú:
- Jednoduchý názov (TS)
- %hmotnosť/hmotnosť (%P/P) alebo hmotnosť/hmotnosť (%m/m)
- %Hmotnosť/objem (%P/V) alebo hmotnosť/objem (%m/v)
- % objem/objem (% v/v)
- Diely na milión hmotnosti/hmotnosti (ppmp/p) alebo hmotnosť/hmotnosť (ppmm/m)
- Diely na milión hmotnosti/objemu (ppmp/v) alebo hmotnosť/objem (ppmm/v)
- Diely na milión objemu/objemu (ppmV/v)
Chemické koncentračné jednotky
V prípade chemických jednotiek sú množstvo rozpustenej látky a v niektorých prípadoch rozpúšťadla alebo roztoku vyjadrené podľa počtu častíc alebo krtkov alebo ekvivalentov prítomných v roztoku.
Nazývajú sa chemické jednotky, pretože dve roztoky, ktoré majú rovnakú chemickú koncentráciu, majú rovnocenné množstvá atómov, molekúl alebo rozpustených iónov na jednotku roztoku.
Môže vám slúžiť: Pravidlá rozpustnosti: Všeobecné aspekty a pravidláNajbežnejšie chemické jednotky sú:
- Molarita (m)
- Molita (m)
- Molárna frakcia (x)
- Normalita (n)
Vzorec fyzických koncentračných jednotiek
Jednoduchý názov (TS)
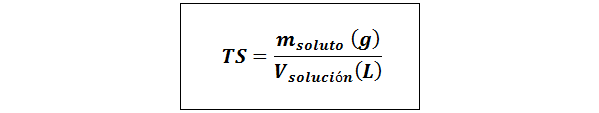
Kde mrozpustenie predstavuje hmotnosť rozpustenej látky v gramoch a vRiešenie Je to objem roztoku v litroch.
%hmotnosť/hmotnosť (%P/P) alebo hmotnosť/hmotnosť (%m/m)
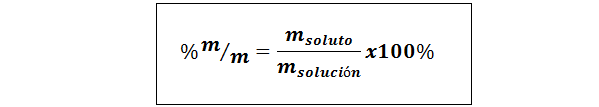
Kde mrozpustenie a mRiešenie predstavuje hmotnosť rozpusteného a roztoku. Môže sa použiť každá jednotka hmoty (g, mg, kg atď.), pokiaľ sú obe hmoty vyjadrené v tej istej jednotke.
%Hmotnosť/objem (%P/V) alebo hmotnosť/objem (%m/v)
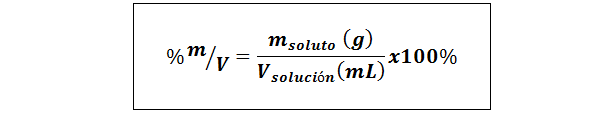
Kde mrozpustenie Je to hmotnosť roztoku v gramoch a vRiešenie Je to objem roztoku, v tomto prípade v mililitroch.
% objem/objem (% v/v)

Kde vrozpustenie a vRiešenie predstavuje objem rozpustenej látky a roztok. V tomto prípade môže byť každá jednotka použitá na vyjadrenie týchto objemov, pokiaľ je to isté pre oboje.
Diely na milión hmotnosti/hmotnosti (ppmp/p) alebo hmotnosť/hmotnosť (ppmm/m)
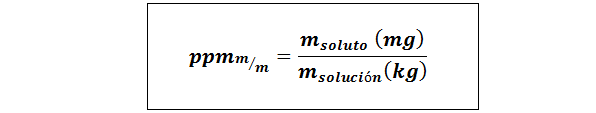
Kde mrozpustenie a mRiešenie Predstavujú hmotnosť rozpustenej látky a roztok v miligramoch a kilogramoch.
Diely na milión hmotnosti/objemu (ppmp/v) alebo hmotnosť/objem (ppmm/v)
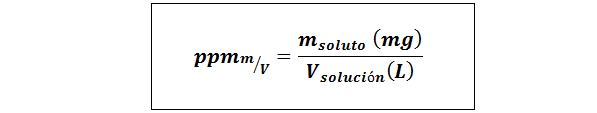
Kde mrozpustenie Je to hmotnosť riešenia v miligramoch a vRiešenie Je to objem riešenia, v tomto prípade v litroch.
Diely na milión objemu/objemu (ppmV/v)
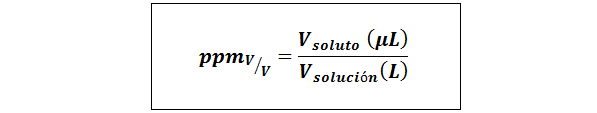
Kde vrozpustenie a vRiešenie Sú objemom rozpustenej látky a roztokom v mikrolitroch a litroch.
Vzorce jednotiek chemickej koncentrácie
V prípade jednotiek chemickej koncentrácie je množstvo zložiek roztoku, najmä z rozpustenej látky, vyjadrené buď v počte mólov alebo v počte ekvivalentov. Tieto množstvá majú skutočný počet častíc (atómy, molekuly alebo ióny, ako to môže byť).
Tieto množstvá nemôžu byť známe jednoducho vážením alebo meraním objemu látok, ale je potrebné poznať zloženie alebo chemický vzorec zlúčenín, aby sa stanovila koncentrácia. To je hlavný dôvod, prečo sa nazývajú chemické koncentrácie.
Ďalej sú uvedené rôzne vzorce na výpočet štyroch najbežnejšie používaných chemických koncentrácií:
Molarita (m)
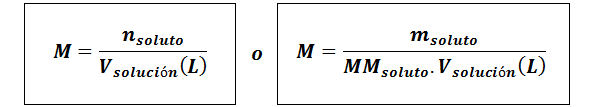
Kderozpustenie Sú to móly rozpustenej látky, mrozpustenie predstavuje hmotnosť rozpustenej látky v gramoch, mmrozpustenie je jeho molárna hmota a vRiešenie Je to objem roztoku v litroch.
Molita (m)
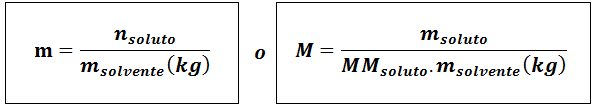
Kderozpustenie Sú to móly rozpustenej látky, mrozpustenie predstavuje hmotnosť rozpustenej látky v gramoch, mmrozpustenie Je to jeho molárna hmota a msolventný Je to hmotnosť rozpúšťadla v kilogramoch.
Môže vám slúžiť: SolvatáciaMolárna frakcia (x)
Molárna frakcia sa môže vypočítať pre rozpustenú látku aj pre rozpúšťadlo. Molárna frakcia rozpustenej látky je:
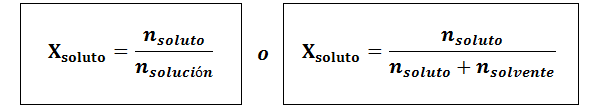
Rozpúšťadlo je:
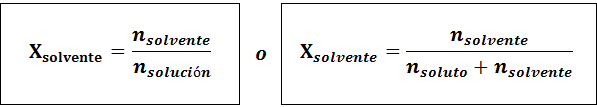
Vzťah medzi oboma molárnymi frakciami je:
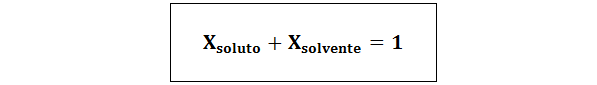
Vo všetkých prípadoch nrozpustenie, nRiešenie a nsolventný sú móly rozpustenej látky, roztoku a rozpúšťadla.
Normalita (n)
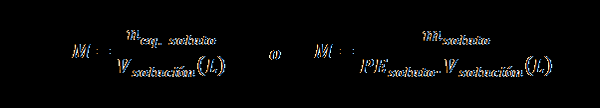
Tu nrovnica. rozpustenie predstavuje počet ekvivalentu rozpustenej látky, mrozpustenie predstavuje hmotnosť rozpustenej látky, PErozpustenie Je to ekvivalentná hmotnosť rozpusteného a VRiešenie Je to objem roztoku v litroch.
Príklady chemickej koncentrácie
- Koncentrácia soli v morskej vode je 35 g/l, čo zodpovedá molarite 0,60 mol/l.
- Priemerná koncentrácia cukru v krvi je medzi 82 mg/dl a 110 mg/dl. Tieto koncentrácie sú ekvivalentné jednoduchému názvu pri 0,82 g/l a 1,10 g/l a v molarite pri 4,4.10-3 mol/l a 6.1.10-3 mol/l.
- Vzduch sa môže považovať za plynný roztok tvorený hlavne dusík a kyslík, pričom rozpúšťadlo je dusík, pretože je vo väčšom pomere. Tento roztok plynu obsahuje 0,22 kyslíka a frakciu dusíka približne 0,78.
- Oceľ je zliatina medzi železom a uhlíkom. Aj keď to nie sú prísne roztoky, jedná sa o homogénne tuhé zmesi, ktoré zvyčajne obsahujú koncentráciu uhlíka v poradí 0,03% a 1 075% v hmotnosti.
- Napriek svojim ničivým účinkom na životné prostredie a zdravie ľudských bytostí sú koncentrácie mnohých znečisťujúcich látok zvyčajne značne nízke. Príkladom je maximálna koncentrácia jedovatého kovu arzénu vo vode. Svetová zdravotnícka organizácia (WHO) preukázala, že pitná voda by nemala obsahovať koncentráciu arzénu vyššiu ako 10 ppb m/v (časti na miliardu alebo nanogramy na liter). Táto koncentrácia je rovnocenná s 0.010 ppm m/v.
Odkazy
- BBC (s. F.). Koncentrácia roztokov - Výpočty v chémii - AQA - GCSE Chemistry (Single Science) Recenzia - AQA. BBC vzatý.co.Uk.
- Tu je to, čo znamená koncentrácia v chémii (2020). Pokusne z Thoughtco.com.
- Librettexts (2022). 4.5: Koncentrácia roztokov. Prevzaté z Chem.Librettexts.orgán.
- Mandal, a., Md. (2021). Normálne hodnoty cukru v krvi. Prevzatý z spravodajských stredných ako.slepo.
- Chemikálie.Sieť. F.). Chemické koncentrácie. Prevzaté z chemiky.slepo.

