Charakteristiky, výcvik, príklady
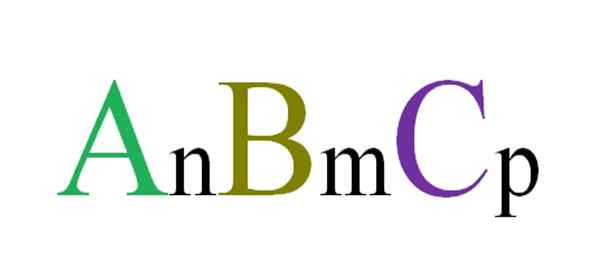
- 3211
- 83
- Adrián Fajnor
Ten Ternárne zlúčeniny Sú to všetci tí, ktorí sa skladajú z troch rôznych atómov alebo iónov. Môžu byť veľmi rozmanité, od kyslých alebo základných látok, po zliatiny kovov, minerály alebo moderné materiály. Tri atómy môžu patriť do tej istej skupiny periodickej tabuľky alebo pokračovať v ľubovoľných miestach.
Aby sa však vyskytla ternárna zlúčenina, musí existovať chemická afinita medzi jej atómami. Nie všetci sú navzájom kompatibilné, a preto si nemôžete jednoducho zvoliť náhodne, ktoré tri budú integrovať a definovať zlúčeninu alebo zmes (za predpokladu nedostatku kovalentných väzieb).
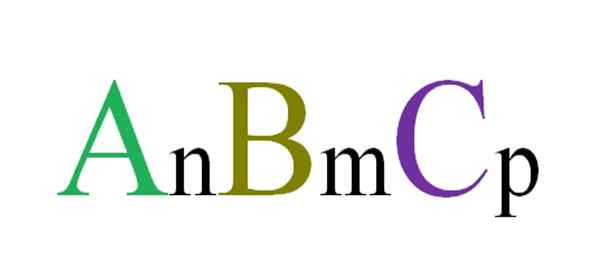 Všeobecný a náhodný vzorec pre ternárne zlúčeniny. Zdroj: Gabriel Bolívar.
Všeobecný a náhodný vzorec pre ternárne zlúčeniny. Zdroj: Gabriel Bolívar. Napríklad sú náhodne vybrané tri písmená, ktoré budú riadiť ternárnu zlúčeninu ABC (vynikajúci obraz). Predplatné N, M a P označujú stechiometrické vzťahy medzi atómami alebo iónmi A, B a C. Meniace hodnoty takýchto predplatných a identity písmen sa získajú nekonečné ternárne zlúčeniny.
Vzorec A všaknBmCp Platí to iba vtedy, ak splní elektroneutralitu; to znamená, že súčet vašich poplatkov sa musí rovnať nule. S ohľadom na to existujú fyzikálne (a chemické) obmedzenia, ktoré usmerňujú, či je možné tvorbu uvedenej ternárnej zlúčeniny alebo nie.
[TOC]
Charakteristiky ternárnych zlúčenín
Jeho charakteristiky nie sú všeobecné, ale líšia sa v závislosti od ich chemickej povahy. Napríklad oxoacidy a základne sú ternárne zlúčeniny a každá z nich zdieľa alebo nie sériu reprezentatívnych charakteristík.
Teraz, pred hypotetickou zlúčeninou ABC, to môže byť iónové, ak rozdiely v elektronegativite medzi A, B a C nie sú veľké; alebo kovalentné, s odkazmi A-B-C. Posledne menované sú uvedené v nekonečných príkladoch v organickej chémii, ako u alkoholov, fenolov, éterov, sacharidov atď., ktorých vzorce možno opísať s CnHm Anip.
Môže vám slúžiť: Mechanické vlastnosti kovovCharakteristiky sú teda veľmi rozmanité a oscilujú vo vysokom stupni jednej ternárnej zlúčeniny do druhej. Zlúčenina CnHmAnip Hovorí sa, že je okysličovaný; zatiaľ čo cnHmNp, Na druhej strane je to dusík (je to amín). Ostatné zlúčeniny môžu byť síra, fosforované, fluorizované alebo majú výrazný kovový charakter.
Bázy a kyseliny
Pokrok v oblasti anorganickej chémie, máte kovové základne, mnAnimHp. Poskytnúť.
Napríklad základná základňa, berúc do úvahy takéto predplatné, by sa mala písať ako NA1Ani1H1 (čo by bolo chaotické). Okrem toho by sa predpokladalo, že H je katión H+, A nie ako sa to skutočne javí: byť súčasťou aniónu Oh-. Kvôli pôsobeniu OH- Na koži sú tieto základne mydlá a žieravé.
Kovové bázy sú iónové látky, a hoci pozostávajú z dvoch iónov, mn+ a oh- (Na+ a oh- Pre NaOH), sú to ternárne zlúčeniny pre tri rôzne atómy.
Na druhej strane sú kyseliny kovalentné a ich všeobecný vzorec je hao, kde je zvyčajne nemetalický atóm zvyčajne. Avšak vzhľadom na to, že je to jednoduché ionizované vo vode uvoľňujúcich vodíky, jeho H ióny+ Podriadený a ublížiť pokožke.
Menovanie
Rovnako ako charakteristiky, aj nomenklatúra ternárnych zlúčenín je veľmi rozmanitá. Z tohto dôvodu sa povrchne budú považovať iba za základy, oxoacidy a oxizály.
Základne
Kovové základne sa spomínajú najskôr so slovom „hydroxid“, po ktorom nasleduje názov kovu a jeho valencia v rímskych číslach v zátvorkách. NaOH je teda hydroxid sodný (i); Ale pretože sodík má jedinečnú valenciu +1, zostáva jednoducho ako hydroxid sodný.
Môže vám slúžiť: AlceansAl (Oh)3, Napríklad je to hliníkový hydroxid (III); a cu (oh)2, Hydroxid medený (II). Samozrejme, všetko podľa systematickej nomenklatúry.
Oxoacidy
Oxóacidy majú pomerne všeobecný vzorec typu HAO; Ale v skutočnosti sú lepšie opísané ako AOH. Ha-H odkaz sa objaví, je to prepustené+.
Tradičná nomenklatúra je nasledovná: Slovo „kyselina“ začína, po ktorom nasleduje meno centrálneho atómu, ktorému predchádzalo alebo predchádzalo ich príslušné predpony (hypo, per) alebo prípony (medveď, ICO) podľa toho, či pracuje so svojimi maloletými alebo staršie valencie.
Napríklad oxoacidy brómov sú Hbro, hbro2, Hbro3 a Hbro4. Sú to kyseliny: hypobromózne, bromické, bromické a perbromické, respektíve. Všimnite si, že vo všetkých z nich sú pre svoje predplatné tri atómy s rôznymi hodnotami.
Oxizála
Tiež sa nazývajú nullionové soli, sú najreprezentatívnejšími ternárnymi zlúčeninami. Jediným rozdielom, že ich spomeniem, je to, že medveď a ICO Sufijos sa menia pre ITO a ATO, respektíve. H je tiež nahradený kovovým katiónom, čo je produkt neutralizácie kyslou bázou.
Pokračovanie s brómom by jej oxizály sodného boli: Nabro, Nabro2, Nabro3 a nabro4. Ich mená by sa stali: hipobromito, bromito, bromato a perbromát sodný. Počet možných oxizálov nepochybne presahuje počet oxoacidových.
Výcvik
Každý typ ternárnej zlúčeniny má opäť svoj vlastný pôvod alebo školiaci proces. Je však spravodlivé spomenúť, že tieto sa dajú formovať iba vtedy, ak existuje dostatočná afinita medzi tromi členmi atómov. Napríklad kovové základne existujú vďaka elektrostatickým interakciám medzi katiónmi a OH-.
Môže vám slúžiť: kyselina citrónováNiečo podobné sa stáva s kyselinami, čo sa nedalo vytvoriť, ak neexistovala taká kovalentná väzba A-O-H.
Na základe otázky, ako sa tvoria hlavné zlúčeniny? Priama odpoveď je nasledovná:
- Kovové bázy sa tvoria rozpustením oxidov kovov vo vode alebo v alkalickom roztoku (zvyčajne poskytované NaOH alebo amoniakom).
- Oxoacidy sú produktom rozpustenia nemetalických oxidov vo vode; Medzi nimi, CO2, Clo2, Nie2, SW3, P4Ani10, atď.
- A potom sa oxizály objavia, keď sú oxoacidy alkalilizované alebo neutralizované kovovým základom; Z toho prichádzajú kovové katióny, ktoré sa dodávajú h+.
Ostatné ternárne zlúčeniny sa tvoria po zložitejšom procese, rovnako ako v prípade určitých zliatin alebo minerálov.
Príklady
Nakoniec sa ako zoznam zobrazí séria vzorcov pre rôzne ternárne zlúčeniny:
- Mg (oh)2
- CR (OH)3
- Kmno4
- Nat3Bož3
- CD (OH)2
- Starší brat3
- Feaso4
- Bacr2Ani7
- H2SW4
- H2Teo4
- HCN
- Pred
Ďalšími menej častými (a dokonca hypotetickými) príkladmi sú:
- Cofecu
- Algasn
- Ucapb
- Bemgo2
Predplatné N, M a P boli vynechané tak, aby nezkomplikovali vzorce; Aj keď v skutočnosti, jeho stechiometrické koeficienty (s výnimkou toho najlepšieho pre Bemgo2), môžu mať dokonca desatinné hodnoty.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- PANI. Hilfstein. (s.F.). Ternárny comununds. Zotavené z: Tenafly.K12.Nj.my
- Wikipedia. (2019). Ternárny obchod. Zdroj: In.Wikipedia.orgán
- Carmen Bello, Arantxa Isasi, Ana Puerto, Germán Tomás a Ruth Vicente. (s.F.). Ternárne zlúčeniny. Získané z: iedmjac.Vzdeláva.Aragón.je
- « Charakteristiky kvartérnych zlúčenín, výcvik, príklady
- Charakteristiky špeciálnych zlúčenín, školenie, použitie »

