Charakteristiky kvartérnych zlúčenín, výcvik, príklady
- 3612
- 598
- JUDr. Rudolf Čapkovič
Ten Kvartérne zlúčeniny Sú to všetci tí, ktorí majú štyri rôzne atómy alebo ióny. Preto môžu byť molekulárnymi alebo iónovými druhmi. Jej rozmanitosť sa vzťahuje na organickú aj anorganickú chémiu, ktorá je veľmi objemnou skupinou; Aj keď možno nie toľko v porovnaní s binárnymi alebo ternárnymi zlúčeninami.
Dôvod, prečo je vaše číslo menšie, je ten, že štyri atómy alebo ióny musia byť ujednané podľa ich chemických príbuzných. Nie všetky prvky sú navzájom kompatibilné a ešte menej, ak sa považujú za kvarteto; Zrazu pár z nich viac súvisí so sebou ako s druhým párom.
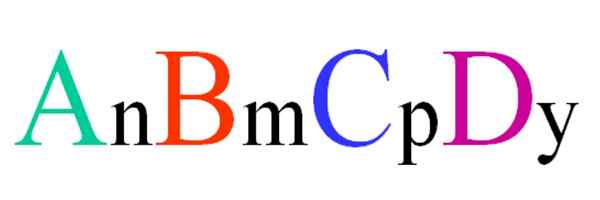 Všeobecný a náhodný vzorec pre kvartérnu zlúčeninu. Zdroj: Gabriel Bolívar.
Všeobecný a náhodný vzorec pre kvartérnu zlúčeninu. Zdroj: Gabriel Bolívar. Zvážte kvartérnu zlúčeninu náhodného vzorca ABCD. Predplatné N, M, P e Y sú stechiometrické koeficienty, ktoré zase naznačujú, aký podiel každého atómu existuje vo vzťahu k ostatným.
Teda vzorec AnBmCpDa Bude platné, ak splní elektroneutralitu. Okrem toho bude takáto zlúčenina možná, ak sú ich štyri atómy navzájom dostatočne blízko. Zistí sa, že tento vzorec sa nevzťahuje na mnoho zlúčenín, ale najmä na zliatiny alebo minerály.
[TOC]
Charakteristiky kvartérnych zlúčenín
Chemikálie
Kvartérna zlúčenina môže byť iónová alebo kovalentná a vykazuje očakávané vlastnosti svojej povahy. Očakáva sa, že ABCD iónové zlúčeniny budú rozpustné vo vode, alkoholu alebo v iných polárnych rozpúšťadlách; Musia mať vysoké vary a fúzne body a byť dobrým vodičom elektriny, keď sa zlúčia.
Pokiaľ ide o kovalentné zlúčeniny ABCD, väčšina pozostáva z dusíka, okysličených alebo halogénovaných organických zlúčenín; to znamená, že jeho vzorec by sa stal CnHmAnipNa alebo cnHmAnipXa, X je halogén atóm. Z týchto molekúl by bolo logické myslieť si, že boli polárne, vzhľadom na vysoké elektronegativity O, N a X.
Môže vám slúžiť: chlorid sodný (NaCl)Čisto kovalentná zlúčenina ABCD môže mať veľa možností odkazov: A-B, B-C, D-A atď., V závislosti od príbuznosti a elektronických schopností atómov. Zatiaľ čo v čisto iónovej zlúčenine ABCD, jeho interakcie sú elektrostatické: a+B-C+D-, Napríklad.
V prípade zliatiny, považovaná za viac pevnú zmes ako zlúčenina, ABCD pozostáva z neutrálnych atómov v bazálnych stavoch (teoreticky).
Zvyšku môže byť zlúčenina ABCD neutrálna, kyslá alebo základná, v závislosti od identity jeho atómov.
Fyzický
Fyzicky povedané, je pravdepodobné, že ABCD sa nestane plynom, pretože štyri rôzne atómy vždy zahŕňajú väčšiu molekulárnu hmotnosť alebo formulujú. Ak nejde o tekutinu s vysokým bodom varu, očakáva sa, že bude tuhá, ktorej rozklad musí generovať veľa výrobkov.
Opäť platí, že jeho farby, vôňa, textúra, kryštály atď., Budú predmetom toho, ako koexistujú v areáli A, B, C a D v zlúčenine, a budú závisieť od ich synergie a štruktúr.
Menovanie
Doteraz sa otázka kvartérnych zlúčenín vyriešila globálnym a nepokojným spôsobom. Zanechanie organickej chémie stranou (Amidas, Lachilo chloridy, kvartérne amónne soli atď.), V anorganickej chémii existujú dobre definované príklady nazývané kyslé a základné oxizály.
Kyslé oxizále
Kyslé oxizály sú tie, ktoré pochádzajú z čiastočnej neutralizácie polyprotickej oxoacidy. Jeden alebo viac jeho hydrogénov sa teda nahradí kovovými katiónmi a čím menej má zvyškový vodík, tým menej kyslý bude.
Napríklad kyselina fosforečná, h3Po4, Od sodíka je možné získať až dva kyslé soli. To sú: nie2Po4 (Na+ nahrádza vodík ekvivalent k H+) a na2HPO4.
Môže vám slúžiť: selén: História, vlastnosti, štruktúra, získanie, použitiePodľa tradičnej nomenklatúry sú tieto soli pomenované ako aj oxizály (úplne nechránené), ale predchádzajú slovu „kyselina“ k názvu kovu. Tak, nie2Po4 Bol by to fosforečnanom sodným a NA2HPO4 Fosforečnan kyseliny sodného (pretože má H.
Na druhej strane, zásobová nomenklatúra uprednostňuje použitie slova „vodík“, ktoré „kyselina“. NAH2Po4 Bolo by to byť dihydrogén sodný a NA2HPO4 Fosforečnanový vodík. Všimnite si, že tieto soli majú štyri atómy: Na, H, P a O.
Základné oxizále
Základné oxizály sú tie, ktoré vo svojom kompozícii obsahujú anión OH-. Zvážte napríklad Salt Cano3Oh (CA2+ Nie3- Oh-). Aby som to pomenoval, stačilo by dať slovo „základné“ mene kovu. Jeho meno by bolo: základný dusičnan vápenatého. A čo tak Cuio3Oh? Jeho meno by bolo: Cupric Basic Yodato (Cu2+ Io3- Oh-).
Podľa nomenklatúry zásob je slovo „základné“ nahradené hydroxidom, po ktorom nasleduje použitie skriptu pred menom Oxoanion.
Opakovanie predchádzajúcich príkladov ich názvy by boli pre každú z nich: dusičnan hydroxid vápenatý a hydroxid-andodát medený (II); Pamätajte si, že kovová valencia musí byť uvedená v zátvorkách a s rímskymi číslami.
Dvojité soli
V dvojitých soli existujú dva rôzne katióny interagujúce s rovnakým typom aniónu. Predpokladajme, že dvojitá soľ: cu3Viera (po4)3 (Cu2+ Vernosť3+ Po43-). Je to fosfát železa a medi, ale najvhodnejším názvom na toto je: Triple Copper (II) a železo (III) fosfát.
Hydratované soli
Jedná sa o hydráty a jediný rozdiel je v tom, že na konci ich názvov je uvedený počet formulácií vody. Napríklad MNCL2 Je to chlorid mangánu (II).
Môže vám slúžiť: benzoín: štruktúra, vlastnosti, použitia a rizikáJeho hydrát, MNCL24H2O sa nazýva chlorid mangánu (ii) tetrahydrát. Všimnite si, že existujú štyri rôzne atómy: Mn, Cl, H a O.
Slávna dvojitá a hydratovaná soľ je Mohrova viera (NH4)2(SW4)2· 6h2Ani. Volá sa: Dvojité železné sulfát (II) a hexahydrát amónny.
Výcvik
Zameranie na anorganické kvartérne zlúčeniny máme väčšinou produkt čiastočných neutralizácií. Ak sa vyskytnú v prítomnosti niekoľkých oxidov kovov, sú pravdepodobné dvojité soli; A ak je médium veľmi základné, základné oxizále sa zrážajú.
A ak na druhej strane, molekuly vody majú afinitu k kovu, budú sa priamo koordinovať s ním alebo s okolitými iónmi a tvoria hydráty.
Na boku zliatin musia byť na výrobu kondenzátorov, polovodičov alebo tranzistorov zvárané štyri rôzne kovy alebo metaloidy.
Príklady
Nakoniec je uvedený zoznam s rôznymi príkladmi kvartérnych zlúčenín. Čitateľ ho môže použiť na testovanie svojich znalostí o nomenklatúre:
- PBCO3(Oh)2
- CR (HSO4)3
- NAHCO3
- Znioh
- Cu2(Oh)2SW3
- Li2Kaso4
- Cuso4· 5H2Ani
- Agau (tak4)2
- Prípad4· 2h2Ani
- Fecl3· 6h2Ani
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Anorganická nomenklatúra a formulácia. [PDF]. Zdroj: Zdroje.vzdelávanie.je
- Erika thalîa dobrá. (2019). Dvojité soli. Akadémia. Zotavené z: akadémie.Edu
- Wikipedia. (2019). Kvartérny katión. Zdroj: In.Wikipedia.orgán

