Štruktúra chloridu železného chloridu (FECL2), použitie, vlastnosti

- 3032
- 325
- Gabriel Bahna
On chlorid železa Je to anorganická pevná látka tvorená spojením katiónu viery2+ a dva anióny chlorid cl-. Jeho chemický vzorec je fecl2. Má tendenciu absorbovať vodu z životného prostredia. Jedným z jeho hydrátov je fecl tetrahydrát2 •4H2Alebo čo je zelenkavá pevná látka.
Zdôraznite, že je veľmi rozpustný vo vode a má tendenciu ľahko oxidovať v prítomnosti vzduchu tvoriaceho železitý chlorid fecl3. Na ľahko oxiditeľné, a preto je schopný pôsobiť ako reduktor, v chemických a biologických výskumných laboratóriách sa široko používa.
 Ferroso tetrahydrát chlorid fecl2 •4H2Alebo pevný. Craven [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Ferroso tetrahydrát chlorid fecl2 •4H2Alebo pevný. Craven [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Chlorid železa má niekoľko použití, medzi ktorými pomáha iným látkam pri oxidácii kalu odvodených z odpadovej vody alebo čistenia odpadových vôd. Používa sa tiež v procese náteru železa a má určité využitie vo farmaceutickom priemysle.
Skúsilo sa aj o používanie FECL2 Pri regenerácii cenných kovov vynaložených katalyzátorov nachádzajúcich sa vo výfukových potrubiach vozidiel, ktoré pracujú s benzínom alebo naftou.
Používa sa v textilnom priemysle na opravu farieb v niektorých typoch látky.
[TOC]
Štruktúra
Chlorid železia je tvorený iónom železnej viery2+ a dva ióny chlorid cl- United prostredníctvom iónových odkazov.
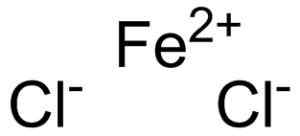 Ferroso chloruro fecl2 kde sú ióny, ktoré to tvoria. EPOP [verejná doména]. Zdroj: Wikimedia Commons.
Ferroso chloruro fecl2 kde sú ióny, ktoré to tvoria. EPOP [verejná doména]. Zdroj: Wikimedia Commons. Železná viera2+ Má nasledujúcu elektronickú štruktúru:
1s2, 2s2 2 P6, 3s2 3p6 3D6, 4s0
kde vidíte, že ste stratili dva elektróny vrstvy 4S.
Táto konfigurácia nie je príliš stabilná a z tohto dôvodu má tendenciu oxidovať, to znamená, že stratíte ďalší elektrón, tentoraz 3D vrstva, ktorý vytvára vieru ión3+.
Z tejto časti ión chlorid cl- Má nasledujúcu elektronickú štruktúru:
1s2, 2s2 2 P6, 3s2 3p6
kde vidíte, že ste získali ďalší elektrón vo vrstve 3p, čo ho dokončite. Táto konfigurácia je veľmi stabilná, pretože všetky elektronické vrstvy sú kompletné.
Menovanie
- Chlorid železa
- Chlorid železa (II)
Môže vám slúžiť: Stanovenie popola: metódy a príklady- Železný dichlorid
- Tetrahydrát chlorid železia: fecl2 •4H2Ani
Vlastnosti
Fyzický stav
Farebné až svetlo zelené kryštály.
Molekulová hmotnosť
126,75 g/mol
Bod topenia
674 ° C
Bod varu
1023 ° C
Špecifická váha
3,16 až 25 ° C/4 ° C
Rozpustnosť
Veľmi rozpustné vo vode: 62,5 g/100 ml pri 20 ° C. Rozpustný v alkoholu, acetone. Mierne rozpustný v benzéne. Prakticky nerozpustné v éteri.
Ďalšie vlastnosti
Fecl2 bezvodý je veľmi hygroskopický. Absorbujte vodu s ľahkosťou životného prostredia a vytvárajú rôzne hydráty, najmä tetrahydrát, v ktorých pre každú molekulu FECL2 Sú 4 h molekuly2Alebo s tým spojené (fecl2 •4H2Buď).
V prítomnosti vzduchu je pomaly oxidáciou na fecl3. To znamená, že viera ión2+ Ľahko oxiduje vieru iónov3+.
Ak sa zahrievate v prítomnosti rýchleho chloridu vzduchu Feric Fecl3 A oxid železitý Fe2Ani3.
Fecl2 Je to korozívne pre kovy a tkanivá.
Získanie
Získa sa ošetrením nadbytku viery železa vodným roztokom kyseliny hydrochlorovodíkovej pri vysokých teplotách pri vysokých teplotách.
Vernosť0 + 2 HCl → FECL2 + 2 h+
Avšak kvôli prítomnosti vody touto metódou sa získa chlorid železitý tetrahydrát2 •4H2Ani.
Na získanie bezvodého (bez vody začleneného do kryštálov) niektorí vedci sa vybrali na vykonanie reakcie železného prachu s kopcami bezvodom (bez vody) v rozpúšťadle tetrahydrofuranu (THF) pri teplote 5 ° C.
FECL zlúčenina sa získa týmto spôsobom2 •1.5thf, ktorý pri zahrievaní pri 80-85 ° C v prázdnote alebo v atmosfére dusíka (na zabránenie prítomnosti vody) produkuje FECL2 bezvodý.
Žiadosti
Chlorid železia má rôzne využitie na základe svojej redukčnej kapacity, to znamená, že ho dá ľahko oxidovať. Používa sa napríklad v maľbách a povlakoch, pretože ich pomáha opraviť z povrchu.
Železo je nevyhnutným mikroživín pre ľudské zdravie a niektoré zvieratá. Je zapojený do syntézy proteínov, dýchania a násobenia buniek.
Preto fecl2 Používa sa vo farmaceutických prípravkoch. Viera ión2+ Ako taký je lepšie absorbovaný ako viera ión3+ V čreve.
Môže vám slúžiť: uhličitan vápenatý: štruktúra, vlastnosti, formovanie, použitiePoužíva sa na výrobu FECL3. Používa sa v metalurgii, v železných povlakoch, na zabezpečenie ťažšieho ložiska.
Tu sú ďalšie významné použitia.
V tkanine sfarbenie
Fecl2 Používa sa ako mordant alebo fixačný sfarbenie v niektorých typoch tkaniny. Mordant reaguje chemicky a súčasne sa spája s farbivom a látkou, ktorá na tomto tvorí nerozpustnú zlúčeninu.
Týmto spôsobom je farbivo pripevnené k látke a jeho farba sa zintenzívni.
 Ferrous chlorid fecl2 Umožňuje pripevnenie farieb na tkaninách. Gina Pina [CC po 2.0 (https: // creativeCommons.Org/licencie/BY/2.0)]. Zdroj: Wikimedia Commons.
Ferrous chlorid fecl2 Umožňuje pripevnenie farieb na tkaninách. Gina Pina [CC po 2.0 (https: // creativeCommons.Org/licencie/BY/2.0)]. Zdroj: Wikimedia Commons. Pri čistení odpadových vôd
Fecl2 Používa sa v čistiarňach odpadových vôd alebo odpadových vôd (kanalizačné vody).
V tejto aplikácii sa chlorid železa podieľa na oxidácii bahna prostredníctvom procesu nazývaného oxidácia Fenton. Táto oxidácia spôsobuje prasknutie bahna a umožňuje uvoľňovanie vody, ktorá je k tomu silne pripevnená.
 Časť čistiarne odpadových vôd, kde môžete vidieť bahno. Niekedy sa to lieči ferroso feclchloridom2 takže sa dá ľahšie oddeliť od vody. Evelyn Simak/kanalizačné práce severne od Dickleburghu. Zdroj: Wikimedia Commons.
Časť čistiarne odpadových vôd, kde môžete vidieť bahno. Niekedy sa to lieči ferroso feclchloridom2 takže sa dá ľahšie oddeliť od vody. Evelyn Simak/kanalizačné práce severne od Dickleburghu. Zdroj: Wikimedia Commons. Potom môže bahno vyschnúť a zlikvidovať. Použitie chloridu železitého pomáha znižovať náklady na procesy.
Nedávno sa tiež navrhlo znížiť tvorbu sulfidového plynu alebo sulfidu vodíka v uvedených kanalizáciách kanalizácií.
Týmto spôsobom by sa korózia produkovala týmto plynom a nepríjemné pachy by sa znížili.
V chemických štúdiách
Pre svoje redukčné vlastnosti (opak oxidácie) FECL2 Všeobecne sa používa v rôznych výskumoch v oblasti chémie, fyziky a inžinierskych laboratórií.
Niektorí vedci použili pary chloridu železité.
Tieto katalyzátory sa používajú na odstránenie škodlivých plynov pre človeka a životné prostredie. Nachádzajú sa v únikovej trubici automobilov a nákladných automobilov, ktoré pracujú s benzínom alebo naftou.
Môže vám slúžiť: molárna hmotnosť: ako sa vypočítava, príklady a vyriešené cvičenia Výfuková trubica vozidla, kde sa pozoruje objemnejšia časť. Ahanix1989 v angličtine Wikipedia [verejná doména]. Zdroj: Wikimedia Commons.
Výfuková trubica vozidla, kde sa pozoruje objemnejšia časť. Ahanix1989 v angličtine Wikipedia [verejná doména]. Zdroj: Wikimedia Commons. Po určitom čase sa katalyzátor vozidla strávi a stráca účinnosť a musíte ho vymeniť. Vyhotovený katalyzátor sa vyradí a vyvíja sa úsilie o obnovenie cenných kovov, ktoré obsahuje.
 Keramická mriežka katalyzátora, kde sa nachádzajú stopy cenných kovov, ktoré sa majú zotaviť pomocou FECL2. Recyklácia globálneho kata [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Keramická mriežka katalyzátora, kde sa nachádzajú stopy cenných kovov, ktoré sa majú zotaviť pomocou FECL2. Recyklácia globálneho kata [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Podľa vedcov so železom chloridu železa tieto kovy tvorili magnetické zliatiny.
Zliatiny sa dajú extrahovať magnetmi a potom sa obnovia hodnotné kovy už známymi metódami.
V biochemických štúdiách
Za vlastníctvo katiónu viery2+, čo je dôležitý mikroživín v ľudskej bytosti a niektorých zvieratách, fecl2 Používa sa v biochémii a štúdiách medicíny.
Určité štúdie umožnili preukázať, že chlorid železitý zlepšuje fungicídnu účinnosť argónovej studenej plazmy.
Cold Plazma je technológia používaná na sterilizáciu lekárskych povrchov a nástrojov. Je založená na tvorbe hydroxylových radikálov OH · Z vlhkosti prostredia. Tieto radikály reagujú s bunkovou stenou mikroorganizmu a spôsobujú ich smrť.
V tomto vyšetrovaní FECL2 Vplyv studenej plazmy sa zlepšil a urýchlil elimináciu huby rezistentných na iné dezinfekčné metódy.
Niektorí vedci zistili, že použitie FECL2 Umožňuje zvyšujúci sa výkonnosť pri získavaní reakcií glukózy na základe bagasky cukrovej trstiny.
V tomto prípade je viera2+ Esenciálny mikroement pre ľudské zdravie, jeho prítomnosť v stopách v produkte by neovplyvnila ľudskú bytosť.
Odkazy
- Fukuda, s. a kol. (2019). Chlorid železitý a železitý sulfát zlepšujú fungicídnu účinnosť studenej atmosférickej argónovej plazmy na melanizovanom aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI sa zotavila.Clm.NIH.Vláda.
- Ismal, alebo.A. a Yildirim, L. (2019). Kovové roubíky a biomordanty. V dopade a vyhliadkach zelenej chémie pre textilnú technológiu. Kapitola 3, s.57-82. Zotavené z vedeckých pracovníkov.com.
- Zhang, W. a kol. (2019). Ko-katalýza chloridu horčíka a chloridu železitého pre xylo-oligosacharidy a výrobu glukózy z cukrovej trstiny bagasse. Bioresoral Technol 2019, 291: 121839. NCBI sa zotavila.NLM.NIH.Vláda.
- Zhou, x. a kol. (2015). Úloha pôvodného železa pri zlepšovaní odvodenia kalu Táto peroxidácia. Vedecké správy 5: 7516. NCBI sa zotavila.NLM.NIH.Vláda.
- Rathnayake, D. a kol. (2019). Kontrola sulfidu vodíka v kanáloch katalyzovaním reakcie kyslíkom. Science of Total Environment 689 (2019) 1192-1200. NCBI sa zotavila.NLM.NIH.Vláda.
- Taninouchi a. a okabe, t.H. (2018). Zotavenie kovov skupiny platiny z utratených katalyzátorov pomocou ošetrenia pary chloridu železného chloridu. Metall a Materi Trans B (2018) 49: 1781. Odkaz obnovený.Prubár.com.
- Alebo.Siež. Lekárska knižnica. (2019). Chlorid železa. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Aresta, m. a kol. (1977). Oxidácia železa (0) chloridom vodíka v tetrahydrofuráne: jednoduchý spôsob k bezvodému železa (ii) chloridu. Anorganic Chemistry, zv. 16, nie. 7, 1977. Získané z krčiem.ACS.orgán.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- « História a význam portugalskej vlajky (revidované obrázky)
- Pôvod kresťanskej etiky, základy, zástupcovia »

