Vlastnosti chloridu olovo, štruktúra, použitie

- 1784
- 136
- Alfréd Blaho
On chlorid Je to anorganická soľ, ktorej chemický vzorec je PBCLn, Kde n je oxidačné číslo olova. Takže, keď je olovo ako +2 alebo +4, soľ je PBCL2 alebo pbcl4, respektíve. Preto existujú dva typy chloridov pre tento kov.
Z týchto dvoch, PBCL2 Je to najdôležitejšie a najstabilné; zatiaľ čo pbcl4 je nestabilný a menej užitočný. Prvým je iónová povaha, kde katión PB2+ generuje elektrostatické interakcie s cl aniónom- vybudovať kryštalickú sieť; A druhý, je kovalentný, s odkazmi Pb-Cl, ktoré pochádzajú z olova a chlóru tetraedron.
 Vyzrážané ihly PBCL2. Zdroj: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Vyzrážané ihly PBCL2. Zdroj: Rrausch1974 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Ďalším rozdielom medzi chloridmi olova je PBCL2 Je to pevná látka z kryštálov bieleho skla (vynikajúci obraz); zatiaľ čo pbcl4 Je to žltkastý olej, ktorý dokáže kryštalizovať pri -15 ° C. Vstup PBCL2 Je to estetické ako PBCL4.
Okrem vyššie uvedených, PBCL2 Nachádza sa v prírode ako kotunitský minerál; zatiaľ čo pbcl4 Nie, pretože je náchylný na rozklady. Zatiaľ čo z PBCL4 Môžete získať PBO2, PBCL2 Odvodzujú nekonečnú škálu organometistických zlúčenín.
[TOC]
Vlastnosti
Vlastnosti chloridu olova závisia v podstate oxidačného čísla olova; Pretože sa chlór nemení, ale robí spôsob, akým interaguje s olovom. Preto sa musia riešiť obe zlúčeniny; Olovo chlorid (ii) na jednej strane a olovo chlorid (IV) na druhej strane.
-Chlorid olovo (II)
Molárna hmota
278,10 g/mol.
Fyzický vzhľad
Biele farebné kryštály s tvarmi ihly.
Hustota
5,85 g/ml.
Bod topenia
501 ° C.
Bod varu
950 ° C.
Rozpustnosť
10,8 g/l pri 20 ° C. Je málo rozpustný a voda sa musí zahriať, aby sa mohlo rozpustiť značné množstvo.
Môže vám slúžiť: nikel hydroxid (ii): štruktúra, vlastnosti, použitia, rizikáIndex lomu
2,199.
Chlorid olovo (IV)
Molárna hmota
349,012 g/mol.
Fyzický vzhľad
Žltkastá.
Hustota
3,2 g/ml.
Bod topenia
-15 ° C.
Bod varu
50 ° C. Pri vyšších teplotách rozkladá uvoľnenie plynného chlóru:
Pbcl4(s) => pbcl2(s) + CL2g)
V skutočnosti môže byť táto reakcia veľmi výbušná, takže PBCL je uložený4 V kyseline sírovej pri -80 ° C.
Štruktúra
-Chlorid olovo (II)
Spočiatku sa zmienilo o tom, že PBCL2 Je to iónová zlúčenina, takže pozostáva z PB iónov2+ a cl- ktorý vytvára kryštál, v ktorom je stanovený pomer PB: Cl rovnajúci sa 1: 2; To znamená, že sú dvakrát a ani CL anióny- Aké katióny pb2+.
Výsledkom je, že sa tvoria orcombické kryštály, ktorých ióny môžu byť reprezentované s guľovými a stĺpcovými modelmi ako v spodnom obrázku.
 Kotunitová štruktúra. Zdroj: Benjah-Bmm27 [verejná doména].
Kotunitová štruktúra. Zdroj: Benjah-Bmm27 [verejná doména]. Táto štruktúra tiež zodpovedá štruktúre kotunitového minerálu. Aj keď sa tyče používajú na označenie smeru iónového spojenia, nemalo by sa zamieňať s kovalentným (alebo aspoň čisto kovalentným) spojením).
V uvedených ortorbických kryštáloch PB2+ (Grillian sféry) má deväť cl- (zelené gule) Okolo ho, akoby bol zamknutý vo vnútri trojuholníkového hranolu. Pre zložitú štruktúru a nízku iónovú hustotu PB2+, Molekuly je ťažké vyriešiť sklo; Dôvod, prečo je málo rozpustný v studenej vode.
Molekula plynnej fázy
Ak ani kryštál ani kvapalina nedokážu odolávať vysokým teplotám, ióny sa začnú odparovať ako molekuly PBCL2 diskrétny; to znamená, že s kovalentnými väzbami CL-PB-CL a uhol 98 °, akoby to bol boomerang. Potom sa hovorí, že plynná fáza pozostáva z týchto molekúl PBCL2 a nie z iónov nesúcich vzduchovými prúdmi.
Môže vám slúžiť: elektronegativitaChlorid olovo (IV)
Medzitým PBCL4 Je to kovalentná zlúčenina. Pretože? Pretože katión PB4+ Je menší a má tiež väčšiu hustotu zaťaženia iónov ako PB2+, čo spôsobuje väčšiu polarizáciu elektronického oblaku CL-. Výsledkom je, že namiesto interakcie iónového typu PB4+Cl-, Vytvorí sa kovalentný odkaz Pb-Cl.
Vzhľadom na to sa chápe podobnosť medzi PBCL4 A napríklad CCL4; Obe sú prezentované ako tetraedrálne jednotlivé molekuly. Vysvetľuje sa teda, prečo je tento chlorid olovo žltkastým olejom za normálnych podmienok; Atómy Cl sú navzájom spojené a „skĺznu“, keď dve molekuly PBCL4 Prichádzajú.
Keď však teplota zostupuje a molekuly sú pomalšie, zvýši sa pravdepodobnosť a účinky okamžitých dipólov (PBCL4 Je to apolar vzhľadom na svoju symetriu); A potom olej zamrzne ako žlté hexagonálne kryštály:
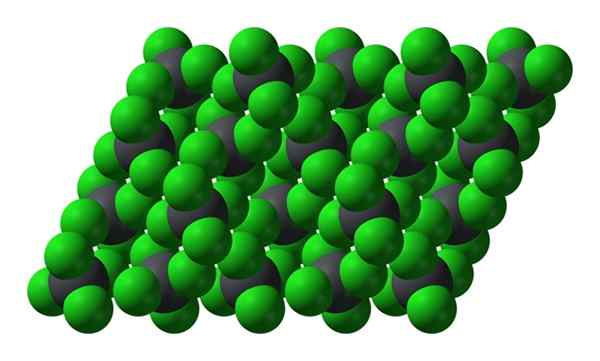 Kryštalická štruktúra PBCl4. Zdroj: Benjah-Bmm27 [verejná doména]
Kryštalická štruktúra PBCl4. Zdroj: Benjah-Bmm27 [verejná doména] Všimnite si, že každá sivastá guľa je obklopená štyrmi zelenými guľami. Tieto molekuly PBCL4 „Squeered“ tvoria nestabilný kryštál a náchylný na rázne rozkladanie.
Menovanie
Mená: Chlorid olovo (II) a chlorid olovo (IV) zodpovedajú menom prideleným podľa nomenklatúry zásob. Pretože oxidačné číslo +2 je najmenšie pre olovo a +4 najväčší, obidva chloridy môžu byť pomenované podľa tradičnej nomenklatúry ako inštalatérsky chlorid (PBCL2) a plúbický chlorid (PBCL4), respektíve.
A nakoniec je systematická nomenklatúra, ktorá zdôrazňuje počet každého atómu zlúčeniny. Teda PBCL2 Je to olovo dichlorid a PBCL4 tetrachlorid.
Môže vám slúžiť: chemická nepreniknuteľnosťŽiadosti
Praktické použitie pre PBCL nie je známe4 Okrem podávania syntézy PBO2. Avšak PBCL2 Je to užitočnejšie, a preto budú uvedené nižšie iba určité použitia tohto špecifického chloridu olova:
- Vďaka svojej vysoko luminiscenčnej povahe je určený na fotografické, akustické, optické a radiačné detektory.
- Neuhadzuje sa v oblasti infračerveného spektra, používa sa na výrobu skla, ktoré vysielajú tento typ žiarenia.
- Bol súčasťou toho, čo nazývajú Aureno Glass, atraktívne materiály dúhových modro sfarbení používaných na ozdobné účely.
- Tiež, podľa témy umenia, keď ste dosiahnuté, PBCL2· Pb (OH)2 získava intenzívne biele odtiene pomocou bieleho olovnatého pigmentu. Jeho použitie sa však odrádzalo kvôli svojej vysokej toxicite.
- Roztavený a zmiešaný s titanitátom bária, Batio3, pochádza z titanato keramiky bária a olovo BA1 −XPbXStrýko3. Ak PB2+ Zadajte batio3, BA2+ Musíte opustiť sklo, aby ste umožnili jeho začlenenie, a potom sa hovorí, že dochádza k výmene katiónov; Preto zloženie BA2+ Je vyjadrená ako 1-x.
- A nakoniec z PBCL2 Niekoľko organometalických zlúčenín všeobecnej receptúry Rumula je syntetizovaných r4Pb alebo r3Pb-pBr3.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Olovo (ii) chlorid. Zdroj: In.Wikipedia.orgán
- Chemická formulácia. (2019). Chlorid olovo (IV). Získané z: Quimica Formulation.com
- Clark Jim. (2015). Chloridy uhlíka, kremíka a olovo. Získané z: Chemguide.co.Uk
- Spektrálne a optické nelineárne štúdie o chloride olovo (PBCL2) Kryštály. [PDF]. Získané z: Shodhganga.Infibnet.Ac.v
- Národné centrum pre biotechnologické informácie. (2019). Chlorid. Databáza PubChem; CID = 24459. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- « Vlastnosti chloridu mangánu, štruktúra, použitie, riziká
- Náklady na konverziu Ako vypočítané a príklady »

