Vlastnosti chloridu mangánu, štruktúra, použitie, riziká

- 3892
- 321
- Alfréd Blaho
On chlorid mangánu Je to anorganická soľ, ktorej chemický vzorec je MCL2. Pozostáva z MN iónov2+ a cl- v pomere 1: 2; pre každú katión Mn2+ Sú dvakrát z CL aniónov-.
Táto soľ môže tvoriť niekoľko hydrátov: MNCL2· 2h2Alebo (dihydrát), mcl24H2Alebo (tetrahydrát) a MCL2· 6h2Alebo (hexahydrát) Najbežnejšou formou soli je tetrahydrát.
 Kryštály ružového mangánu chloridu. Zdroj: Ondřej Mangl [verejná doména]
Kryštály ružového mangánu chloridu. Zdroj: Ondřej Mangl [verejná doména] Fyzikálne vlastnosti chloridu mangánu, ako je hustota, topenie a rozpustnosť vo vode, sú ovplyvňované ich stupňom hydratácie. Napríklad bod topenia formy anhydry je oveľa väčší ako bod tetrahydrátovej formy.
Farba chloridu mangánu je svetlo ružová (vynikajúci obrázok). Bledosť je charakteristická pre prechodné kovy soli. Chlorid mangánu je slabá Lewisová kyselina.
Minerál známy ako Escacquita je prírodná bezvodá forma chloridu mangánu (II); Ako Kempita.
Chlorid mangánu (II) sa používa ako zliatinové činidlo; Katalyzátor v chloričných reakciách atď.
[TOC]
Fyzikálne vlastnosti
Fyzický vzhľad
- Forma anhydry: ružové kubické kryštály.
- Tetrahydrát forma: mierne jemné červenkasté monoklinické kryštály.
Molárne masy
- Anhidro: 125 838 g/mol.
- Dihydrared: 161 874 g/mol.
- Tetrahydrát: 197,91 g/mol.
Fúzne body
- Anhidro: 654 ° C.
- Dihydrared: 135 ° C.
- Tetrahydrát: 58 ° C.
Bod varu
Forma Anhidra: 1.190 ° C.
Hustota
- Bezvodý: 2 977 g/cm3.
- Dihydrared: 2,27 g/cm3.
- Tetrahydrát: 2,01 g/cm3.
Rozpustnosť
Forma Anhydra: 63,4 g/100 ml pri 0 ° C; 73,9 g/100 ml pri 20 ° C; 88,5 g/100 ml pri 40 ° C; a 123,8 g/100 ml pri 100 ° C.
Rozpustnosť v organických rozpúšťadlách
Rozpustný v pyridíne a etanole, nerozpustný v éteri.
Rozklad
Pokiaľ sa neprijmú bezpečnostné opatrenia, dehydratácia hydratovaných tvarov do bezvodej formy môže spôsobiť hydrolytickú dehydratáciu s výrobou chloridu vodíka a oxychloridu mangánu.
pH
0,2 m roztok tetrahydrátového chloridu mangánu vo vodnom roztoku má pH 5,5.
Môže vám slúžiť: chromatogramStabilita
Je stabilný, ale citlivý na vlhkosť a nekompatibilný so silnými kyselinami, reaktívnymi kovmi a peroxidom vodíka.
Štruktúra chloridu mangánu
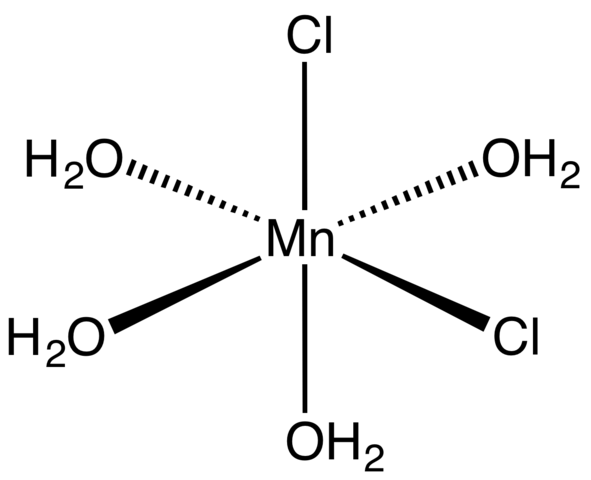 Koordinačný komplex pre MNCL2 tetrahydrát. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Koordinačný komplex pre MNCL2 tetrahydrát. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Počnúc tetrahydrátovými soľou, ružovými a nápadnými kryštálmi sa musí skladať z koordinačných komplexov (vynikajúci obraz). V nich MN Metallic Center2+ je obklopený oktaedrónom definovanými štyrmi molekulami H2Alebo dve CL anióny-.
Všimnite si, že CLIGANDS- Sú v pozíciách CIS; Všetky sú ekvivalentné v obdĺžnikovej základni oktaedra a nezáleží na tom, či sa CL „pohybuje“- do ktorejkoľvek z ďalších troch pozícií. Ďalším možným izomérom pre túto koordinovanú molekulu je, v ktorej obidve Cl- Sú v trans -pozíciách; to znamená na rôznych koncoch (jeden vyššie a druhý nižšie).
Štyri molekuly vody s ich vodíkovými mostmi umožňujú, aby sa dve alebo viac oktaedry spojili. Tieto mosty sú vysoko smerové a pridávajú elektrostatické interakcie medzi MN2+ a cl-, Vytvárajú usporiadanú štruktúru charakteristickú pre kryštál.
Ružová farba MNCL24H2Alebo je spôsobený elektronickými prechodmi MN2+ a jeho konfigurácia D5. Podobne poruchy spôsobené blízkosťou molekúl vody a chloridov modifikujú potrebné množstvo energie, aby tieto elektróny museli absorbovať5 Cestovať vyššou úrovňou energie.
Dihydrát
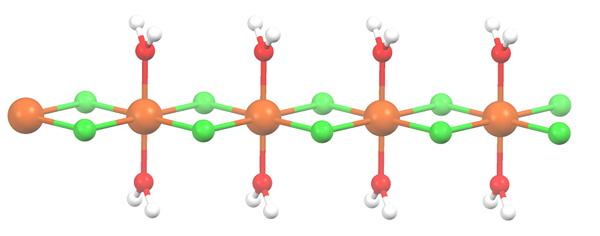 Polymérna štruktúra pre MNCL2 · 2H2O. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Polymérna štruktúra pre MNCL2 · 2H2O. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Soľ sa dehydratuje a jej vzorec sa teraz stáva MCL2· 2h2Ani. Čo sa stane s predným oktadronom? Nič, okrem toho, že dve molekuly H2Alebo že opustené sú nahradené dvoma CL-.
Spočiatku môžete vyvolať nesprávny dojem, že existujú štyri CL- pre každú MN2+; Polovica oktadronu (axiálne) je však v skutočnosti opakujúcou sa jednotkou skla.
Je teda pravda, že existuje Mn2+ koordinovaný v dvoch CL- a dve molekuly vody v trans -pozíciách. Ale aby táto jednotka interagovala s inou, potrebuje dve mosty CL, čo zase umožňuje dokončenie koordinácie oktaedronu pre mangán.
Môže vám slúžiť: diatomické prvkyOkrem mostov CL, molekuly vody tiež spolupracujú s ich vodíkovými mostmi, takže tento reťazec MNCL2· 2h2Alebo neodzbrojte.
Bezvodý
Nakoniec chlorid horčíka dokončil stratu všetkej vody obsiahnutej v jej kryštáloch; Teraz máte soľ anhydra, mcl2. Bez molekúl vody kryštály výrazne strácajú intenzitu svojich ružových sfarbení. Occhedron, rovnako ako pre hydráty, zostáva nezmenený samotnou mangánovou prírodou.
Bez molekúl vody, MN2+ konce obklopené oktadronom zloženým iba z CL-. Toto koordinačné spojenie má kovalentný aj iónový charakter; Z tohto dôvodu sa zvyčajne vzťahuje na štruktúru MNCL2 ako polymérny kryštál. V ňom sú alternatívne vrstvy Mn a Cl.
Menovanie
Mangán má veľa možných oxidačných stavov. Z tohto dôvodu tradičná nomenklatúra pre MNCL2 Nie je objasnená.
Na druhej strane chlorid mangánu zodpovedá svojmu najznámejšiemu menu, ku ktorému by chýbalo „ii)“, aby sa týkalo zásoby nomenklatúry: chlorid mangánu (II). A Asçi, je systematická nomenklatúra: mangánový dichlorid.
Žiadosti
Laboratórium
Chlorid mangánu slúži ako katalyzátor chlorácie organických zlúčenín.
Priemysel
Chlorid mangánu sa používa ako surovina na vypracovanie anti -artisantov pre benzín; zvárací materiál pre neoterné kovy; vypracovanie sprostredkovateľa pigmentov; A linaza ropný nápoj.
Používa sa v textilnom priemysle na tlač a zafarbenie; pri výrobe niekoľkých mangánových solí, vrátane trikarbonilu metylcipentadienilmančiny, sa používal ako tehlové farbivo; a pri výrobe sušených elektrických batérií.
Chlorid mangánu sa používa ako zliatinové činidlo a pridáva sa do roztaveného horčíka na výrobu zliatiny mangánu-Magnéium; ako sprostredkovateľ pri príprave sušiacich agentov na maľovanie a lak; a ako súčasť dezinfekčných prostriedkov.
Môže vám slúžiť: hydroxid sodný (NaOH): štruktúra, vlastnosti, použitia, syntézaPoužíva sa tiež pri čistení horčíka.
Hnojivo a krmivo pre zvieratá
Chlorid mangánu sa používa ako zdroj mangánu, prvku, ktorý, hoci nie je primárnym výživovým prvkom pre rastliny, ako je dusík, fosfor a draslík, sa používa v mnohých biochemických reakciách týchto živých bytostí týchto živých bytostí týchto živých bytostí.
Pridáva tiež krmivo chovných zvierat na dodávku mangánu, čo je nevyhnutné oligoemement pre rast zvierat.
Chlorid mangánu je zložka výživy, ktorá dodáva mangán, prvok, ktorý zasahuje do mnohých procesov potrebných pre život, vrátane: syntézy mastných kyselín a pohlavných hormónov; asimilácia vitamínu E; výroba chrupavky; atď.
Riziká
Môže produkovať kontaktom s začervenaním kože, podráždením a predĺženou dermatitídou expozície. Chlorid mangánu spôsobuje začervenanie, bolesť a roztrhnutie.
Vdýchnutím príčiny soli, bolesti v krku a nedostatok dychu. Na druhej strane sa mohlo vyskytnúť požitie zvracanie, nevoľnosť a hnačka.
Nadmerná chronická inhalácia tejto soli môže viesť k pľúcnemu zápalu a následnému reaktívnemu ochorenia dýchacích ciest.
Jeho nadmerné požitie môže spôsobiť duševné poruchy, dehydratáciu, hypotenziu, zlyhanie pečene a obličiek, zlyhanie multiorgánskeho systému a smrť.
Neurotoxicita je počiatočný prejav nežiaduceho pôsobenia mangánu, ktorý je schopný prezentovať bolesti hlavy, závraty, stratu pamäte, hyperreflexiu a mierny chvenie.
Závažná toxicita sa prejavuje príznakmi a príznakmi podobnými príznakom pozorovaným pri Parkinsonovej chorobe.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Mangán (ii) chlorid. Zdroj: In.Wikipedia.orgán
- Sky Spring Nanomaterials. (2016). Prášok chloridu mangánu. Získané z: ssnano.com
- Chemická kniha. (2017). Chlorid mangán. Obnovené z: Chemicalbook.com
- Toxikologická dátová sieť. (s.F.). Chlorid mangán. Tónovanie. Získané z: Toxnet.NLM.NIH.Vláda
- Gérard Cahiez. (2001). Mangán (ii) chlorid. doi.org/10.1002/047084289x.RM020
- Národné centrum pre biotechnologické informácie. (2019). Dichlorid mangánu. Databáza pubchem. CID = 24480. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- WebConsultas Healthcare, s.Do. (2019). Minerály: mangán. Obnovené z: Web Consultas.com

