Chlorid hliníka (ALCL3)

- 2898
- 383
- Ing. Ervín Petruška
 Vzorec a štruktúra chloridu hliníka
Vzorec a štruktúra chloridu hliníka Čo je hliníkový chlorid?
On chlorid hliníka Je to anorganická chemická zlúčenina, ktorej vzorec je ALCL3. Je prezentovaný ako pevný alebo biely prach, aj keď v dôsledku kontaminácie chloridom železitým a vlhkosťou môže byť žltá. Skladá sa z Lewisovej kyseliny, ale za určitých okolností sa tiež správa ako Lewisova základňa.
Napriek hliníku ako kovu v periodickej tabuľke existuje kovalentná väzba medzi hliníkom a chlórom za vzniku chloridu hliníka.
Táto kovalentná väzba by mohla vysvetliť, prečo je chlorid roztaveného hliníka zlým vodičom elektriny; Zatiaľ čo roztavené soli iných zlúčenín, ako je chlorid sodný, sú dobré vodiče elektriny.
Hliníkový chlorid sa vytvára exotermickou reakciou medzi hliník a chlór alebo chlorid vodíka pri teplote medzi 650 a 750 ° C.
Hliníkový chlorid sa používa ako antitranspirant a na boj proti nadmernému potu. Jeden z jej derivátov sa používa ako koagulačné činidlo pri liečbe priemyselnej odpadovej vody a používa sa tiež ako hlavný katalyzátor chemických reakcií odvetvia.
Štruktúra chloridu hliníka
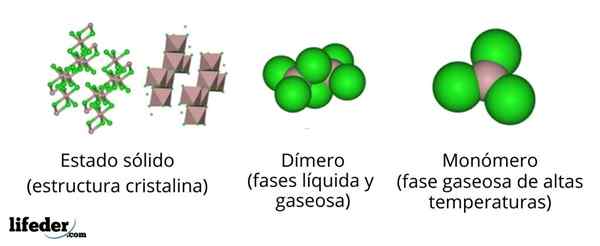
Na hornom obrázku máme rôzne reprezentácie pre každú z kryštalických alebo molekulárnych štruktúr, ktoré vykazujú chlorid bezvodého hliníka, ALCL3, V niekoľkých jeho fyzických štátoch.
Alcl3 Solid pozostáva z monoklinickej kryštalickej štruktúry tvorenej vrstvami oktaedros koordinovaných navzájom. V týchto oktadra (hnedá farba), ión do3+ Je koordinovaný so šiestimi CL iónmi-, Pôsobenie chloridov ako mosty medzi dvoma oktadrami.
Keď sa teplota zvyšuje a je založená ALLL3, Vrstvy sú rozdelené do jednotiek na2Cl6 (Centrum obrazu). Teraz sa hliníkový atóm formuje s tromi atómami chlóru a spojením s ostatným atómom hliníka: CL3Al-alcl3. Tieto diméry vysvetľujú, prečo ALCL3 Roztavenie je menej husté ako jeho kryštály.
Môže vám slúžiť: gadolinio: štruktúra, vlastnosti, získanie, použitieVo fáze pary diméry do2Cl6 Dišia sa navzájom. Ale ak je táto para podrobená vysokým teplotám, dimer sa disociuje v molekulárnych jednotkách ALCL3, v ktorom hliníkový atóm tvorí tri spojenia s atómami chlóru. Alcl3 predstavuje trigonálnu plochú geometriu.
Vlastnosti chloridu hliníka
 Pevná vzorka chloridu hliníka so žltkastými tónmi. Zdroj: XLOLLITOX, CC o 3.0, cez Wikimedia Commons
Pevná vzorka chloridu hliníka so žltkastými tónmi. Zdroj: XLOLLITOX, CC o 3.0, cez Wikimedia Commons Vzorce
Alcl3 (bezvodý)
Alcl3· 6h2O (hexahydrát)
Molárna hmota
133.34 g/mol (anhydro)
241.43 g/mol (hexahydrát)
Fyzický vzhľad
Kryštalický pevný alebo biely prach. Môže sa stať žltkastým odtieňom kvôli kontaminácii chloridom železitým. Môžete tiež prejsť na šedivú farbu pre vlhkosť.
Bod topenia
192.4 ° C
Bod varu
Sublima pri 178 ° C, takže nie je ľahké získať bod varu chloridu hliníka.
Hustota
2.48 g/cm3 (bezvodý)
2.398 g/cm3 (Hexahydrát)
Rozpustnosť
439 g/l a 0 ° C
458 g/l pri 20 ° C
466 g/l A 30 ° C
Chlorid hliníka je hygroskopická zlúčenina, ktorá dokáže absorbovať vodu s mokrou vzduchom a počas procesu emituje dym.
Rozpustnosť v iných rozpúšťadlách
Rozpustný etanol, chloroformy, uhlíkový tetrachlorid, benzofenón a nitrobenzén. Mierne rozpustný v benzéne.
Tlak vodnej pary
13.3 kPa pri 151 ° C (0.131 bankomat).
Hrebeň
0.35 CP až 197 ° C
Reaktivita
Chlorid hliníka je látka amfotátu, to znamená, že sa správa ako kyselina alebo báza. Jeho pôsobenie ako kyselina je však prevaha, pretože chlorid hliníka sa používa ako kyselina Lewis a zároveň je katalyzátorom v mnohých chemických reakciách; Medzi nimi reakcia Friedel-Crafts.
Môže vám slúžiť: Neodymium: Štruktúra, vlastnosti, použitieDokonca aj chlorid hliníka je klasifikovaný ako kyselina, namiesto toho, aby to robil ako soľ.
Chlorid bezvodého hliníka vo vodnom roztoku sa transformuje na hexahydrátovú soľ (ALCL3· 6h2O), ktorý sa nevracia do bezvodej formy otepľovaním.
Hliníkové atómy dvoch molekúl ALCL3 Interagujú navzájom, aby dokončili 8 elektrónov vo svojej valenčnej vrstve, čo vedie k tvorbe diméru do2Cl6. Tento dimér je prítomný v roztavenom hliníkovom chloride a pary.
Chlorid hliníka reaguje s hydroxidom sodným za vzniku hydroxidu hlinitého, želatínovú zrážku:
Alcl3 + NaOH → AL (OH)3 + 3 NaCl
Aplikácie hliníkového chloridu
Antihemoragický
 Chlorid hliníka je súčasťou zložiek použitých pri formuláciách niekoľkých dezodorantov. Zdroj: Th145, CC By-SA 2.0, cez Wikimedia Commons
Chlorid hliníka je súčasťou zložiek použitých pri formuláciách niekoľkých dezodorantov. Zdroj: Th145, CC By-SA 2.0, cez Wikimedia Commons Hliníkový chlorid sa používa ako antitranspirant v osobných dezodorantoch a používa sa tiež na kontrolu nadmerného potu (hyperhidróza). Používa sa tiež vo formuláciách na kontrolu malého krvácania, ako napríklad tie, ktoré sú uvedené v zubných ošetreniach.
Čistenie odpadových vôd
Chlorid hliníka vo forme PAC (polyalumín chlorid) sa používa ako koagulant pri liečbe priemyselnej odpadovej vody kvôli svojej schopnosti objasniť vodu a dehydráty kal.
Katalyzátor
Chlorid hliníka je jedným z hlavných katalyzátorov používaných v priemysle, ktorý pôsobí ako katalyzátor v mnohých reakciách vrátane Friedel-Crafts.
Môže vám slúžiť: Europium: Štruktúra, vlastnosti, získanie, použitieChlorid hliníka katalyzuje prípravné reakcie antrachinónov, z ktorých niektoré sa používajú v textilnom priemysle. Existujú tiež antrachinóny, ktoré majú antibakteriálne, antiparazitické, fungicídne a antivírusové vlastnosti.
Chlorid hliníka katalyzuje reakcie produkované dodecilbenzénom, ktoré sa používajú pri výrobe detergentov a etylbenzén, zlúčenina používaná pri výrobe polystyrénu, polyméru používaného pri vypracovaní plastov, živíc a gumberov a gumov.
Chlorid z hliníka sa tiež používa ako katalyzátor v reakcii, ktorá je súčasťou produkcie vysokého oktánu benzínu. Podobne katalyzuje proces krakovania oleja.
Riziká
Chlorid hliníka je korozívna látka a jej kontakt môže spôsobiť podráždenie a poranenia z kože a očí, čím spôsobí poškodenie očí.
Pri rozpustení vo vode sa môžu uvoľniť jedovaté plyny, ako je chlorid vodíka; Plyny schopné vdýchnuť podráždenie nosa a krku, ktoré sú schopné spôsobiť tvrdé a pľúcne podráždenie. Toto podráždenie môže viesť k akumulácii tekutiny v pľúcach (pľúcny edém), ktorý končí v lekárskej pohotovosti.
Pokúsil sa nadviazať spojenie medzi Alzheimerovou chorobou a chloridom hliníka; Aj keď výsledky výskumu nie sú presvedčivé.
Podobne sa skúmalo spojenie medzi dezodorantmi, ktoré používajú ako anti -transpirant na AllL3 a rakovina prsníka. Výskum nebol schopný preukázať presvedčivý vzťah. V každom prípade chlorid hliníka blokuje prevádzku prírodného detoxikačného systému organizmu a emisie tepla, ako je napríklad pot.
Odkazy
- Wikipedia. (2021). Hliník. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie (2021). Hliník chloridu, Zhrnutie zlúčeniny PubChem pre CID 24012. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- NJ Zdravie. (2008). SKLADOVÁ SKLADOVÁ SKLADOVÁ SPRÁVA: Hliníkový chlorid. [PDF]. Získané z: NJ.Vláda
- Encyclopaedia Britannica. (2021). Hliník. Získané z: Britannica.com
- Elsevier B.Vložka. (2021). Antrachinóny. Vedecký. Zdroj: ScienceDirect.com
- John P. Cunha. (2. mája 2020). Lokálny hliník chloridu. Obnovené z: RXList.com

