História chlóru, vlastnosti, štruktúra, riziká, použitie

- 1706
- 100
- Gabriel Bahna
On chlór Je to chemický prvok, ktorý predstavuje symbol CL. Je to druhý z halogénov, ktorý sa nachádza pod fluór, a je tiež tretím najviac elektronegatívnym prvkom zo všetkých. Jeho meno je odvodené z jeho žltkastej zelenej farby, ktorá je intenzívnejšia ako fluór.
Populárne, keď niekto počúva svoje meno. Aj keď chlór v takýchto príkladoch funguje efektívne, nie je to jeho plyn, ale jeho zlúčeniny (najmä chlórnan), ktoré vyvíjajú odfarbujúci a dezinfekčný účinok.
 Guľatá banka s plynným chlórom vo vnútri. Zdroj: Larenmclane [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Guľatá banka s plynným chlórom vo vnútri. Zdroj: Larenmclane [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Na hornom obrázku je zobrazený okrúhla banka s plynným chlórom. Jeho hustota je väčšia ako hustota vzduchu, čo vysvetľuje, prečo zostáva v banke a neuniká do atmosféry; Rovnako ako v prípade iných ľahších plynov, povedať hélium alebo dusík. V tomto stave je to extrémne toxická látka, pretože produkuje kyselinu chlorovodíkovú v pľúcach.
Preto elementárny alebo plynný chlór nemá príliš veľa použití, viac ako v nejakej syntéze. Jeho zlúčeniny, či už solí alebo chlórované organické molekuly, však pokrývajú dobrý repertoár použitia, umiestnenie za bazény a oblečenie extrémnej bielej.
Jeho atómy vo forme aniónov chloridov sú tiež v našich telách, regulujú hladiny sodíka, vápnika a draslíka, ako aj v žalúdočnej šťavy. Ak nie, príjem chloridu sodného by bol ešte smrteľný.
K chlóru sa vyskytuje prostredníctvom elektrolýzy soľanky, bohatého na chlorid sodný, priemyselný proces, v ktorom sa tiež získava hydroxid sodný a vodík. A pretože moria sú takmer nevyčerpateľným zdrojom tejto soli, potenciálne rezervy tohto prvku v hydrofére sú veľmi veľké.
[TOC]
História
Prvé prístupy
V dôsledku vysokej reaktivity plynného chlóru sa starodávne civilizácie nikdy netušili svojej existencii. Ich zlúčeniny však boli súčasťou kultúry ľudstva z minulých rokov; Jeho história sa začala spájať so spoločnou soľou.
Na druhej strane, chlór vznikol zo sopečných erupcií a keď niekto rozpustil zlato v kráľovskej vode; Ale žiadny z týchto prvých prístupov nestačil na formulovanie myšlienky, že tento žltkastý zelený plyn bol zloženým prvkom.
Objavenie
Objav chlóru sa pripisuje švédskemu chemikovi Carlovi Wilhelmovi Scheeleovi, ktorý v roku 1774 reagoval medzi pyrolusitským minerálom a kyselinou chlorovodíkovou (vtedy nazývanou kyselina muriatová).
Scheele zostáva s úverom, pretože bol prvým vedcom, ktorý študoval vlastnosti chlóru; Aj keď ho predtým uznal (1630) Jan Baptist Van Helmont.
Experimenty, s ktorými Scheele získal svoje pozorovania, sú zaujímavé: hodnotil odfarbujúce pôsobenie chlóru na červenkasté a moderné kvety kvetov, ako aj v listoch rastlín a hmyzu, ktoré okamžite zomreli.
Oznámil tiež svoj vysoký reaktívny voči kovom, jeho dusiaci zápach a nežiaduci účinok na pľúca a že keď sa rozpustil vo vode, jeho kyslosť sa zvýšila.
Kyselina
Dovtedy chemikálie považovali kyselinu pre všetky zlúčeniny, ktoré vlastnili kyslík; Takže zmeškali chlór, ktorý by mal byť plynným oxidom. Bolo to tak, že to nazvali „kyselinou oxyuriatickou“ (oxid kyseliny muriatovej), názov vytvorený slávnym francúzskym chemikom Antoine Lavoisier.
Potom sa v roku 1809 Joseph Louis Gay-Lussac a Louis Jacques Thénard pokúsili znížiť túto uhlíkovú kyselinu; reakcia získaná kovmi z ich oxidov. Týmto spôsobom chceli extrahovať chemický prvok z údajnej kyseliny oximuriatickej (ktorú nazývali „fúzny vzduch muriatickej kyseliny“.
Gay-Lussac a Thénard však zlyhali vo svojich experimentoch; ale boli úspešní, keď sa uvažovali o tom, že uvedený žltkastý zelený plyn by mal byť chemickým prvkom a nie zlúčeninou.
Rozpoznávanie ako prvok
Rozpoznanie chlóru ako chemického prvku bolo vďaka Sir Humphry Davy, ktorý v roku 1810 vykonal svoje vlastné experimenty s uhoľnými elektródami a dospel k záveru, že skutočne existuje taký oxid kyseliny muriatickej kyseliny.
A navyše to bol Davy, ktorý vytvoril názov „chlór“ pre tento prvok z gréckeho slova „chloros“, čo znamená žltkastý.
Keď študovali chemické vlastnosti chlóru, zistilo sa, že mnohé z ich zlúčenín malo soľnú povahu; Preto ho vymenovali za „halogénu“, čo znamená formátor predaja. Potom sa použil termín halogénu s ostatnými prvkami tej istej skupiny (F, BR a I).
Michaelovi Faradayovi sa dokonca podarilo skvapať2· H2Ani.
Môže vám slúžiť: Efektívne jadrové zaťaženieZvyšok histórie chlóru je spojený s jeho dezinfekčnými a bieliacimi vlastnosťami, s rozvojom priemyselného procesu elektrolýz soľanky, aby sa vytvorilo obrovské množstvo chlóru.
Fyzikálne a chemické vlastnosti
Fyzický vzhľad
Je to nepriehľadný žltkastý zelený hustý plyn, dráždivý zápach akra (super zosilnená verzia komerčného chlóru) a je tiež mimoriadne jedovatá.
Atómové číslo (z)
17
Atómová hmotnosť
35,45 u.
Pokiaľ nie je uvedené inak, zvyšky vlastností zodpovedajú veľkosti meraným pre molekulárny chlór, CL2.
Bod varu
-34,04 ° C
Bod topenia
-101,5 ° C
Hustota
-V normálnych podmienkach, 3,2 g/l
-Práve v bode varu, 1 5624 g/ml
Všimnite si, že kvapalný chlór je približne päťkrát viac ako jeho plyn. Hustota jeho pary je tiež 2,49 -krát väčšia ako vzduch. Preto na prvom obrázku chlór nemá tendenciu uniknúť z guľatej banky, pretože hustejší ako vzduch sa nachádza na pozadí. Táto funkcia stále robí nebezpečný plyn.
Fúzne teplo
6 406 kj/mol
Odparovanie
20,41 kj/mol
Kapacita moláru
33,95 J/(mol · k)
Rozpustnosť
1,46 g/100 ml pri 0 ° C
Tlak vodnej pary
7,67 bankomat pri 25 ° C. Tento tlak je relatívne nízky v porovnaní s ostatnými plynmi.
Elektronegativita
3.16 v Pauling Scale.
Ionizačné energie
-Prvé: 1251,2 kj/mol
-Po druhé: 2298 kj/mol
-Tretie: 3822 kj/mol
Tepelná vodivosť
8,9 · 10-3 W/(m · k)
Izotopy
Chlór sa vyskytuje v prírode predovšetkým ako dva izotopy: 35Cl, s množstvom 76%a 37CL, s množstvom 24%. Teda atómová hmotnosť (35,45 U) je priemerom atómových hmôt týchto dvoch izotopov s ich príslušnými percentami hojnosti.
Všetky chlórové rádioizotopy sú umelé, medzi ktoré 36CL ako najstabilnejší, s polovičným životom 300 000 rokov.
Oxidácia
Chlór môže mať niekoľko čísel alebo oxidačných stavov, keď je súčasťou zlúčeniny. Keďže je jedným z najviac elektronegatívnych atómov v periodickej tabuľke, zvyčajne má záporné oxidačné čísla; Okrem prípadu, keď beží s kyslíkom alebo fluórom, v ktorých oxidoch a fluoridoch musí „stratiť“ elektróny.
Vo svojich oxidačných číslach sa predpokladá existencia alebo prítomnosť iónov s rovnakou veľkosťou zaťaženia. Máme teda: -1 (cl-, Slávny chlorid anión), +1 (CL+), +2 (cl2+), +3 (cl3+), +4 (cl4+), +5 (cl5+), +6 (cl6+) a +7 (cl7+). Zo všetkých sú najbežnejšie nachádzajúce sa v chlórovaných zlúčeninách -1, +1, +3, +5 a +7.
Príklady v CLF a CLF3 Oxidačné čísla pre chlór sú +1 (Cl+F-) a +3 (cl3+F3-). V CL2Alebo toto je +1 (cl2+Ani2-); zatiaľ čo v CLO2, Cl2Ani3 a cl2Ani7, Syn +4 (Cl4+Ani22-), +3 (cl23+Ani32-) a +7 (cl27+Ani72-).
Vo všetkých chloridoch má na druhej strane chlór oxidačné číslo -1; ako v prípade NaCl (NA+Cl-), Kde je platné povedať, že CL existuje- Vzhľadom na iónovú povahu tejto soli.
Elektronická štruktúra a konfigurácia
Molekula chlóru
 Diatomická molekula chlóru predstavovaná modelom plnenia priestoru. Zdroj: Benjah-Bmm27 Via Wikipedia.
Diatomická molekula chlóru predstavovaná modelom plnenia priestoru. Zdroj: Benjah-Bmm27 Via Wikipedia. Atómy chlóru v ich bazálnom stave majú nasledujúcu elektronickú konfiguráciu:
[Ne] 3s2 3p5
Preto má každý z nich sedem elektrónov Valencie. Pokiaľ nie sú preťažené energiou, v priestore budú individuálne atómy, akoby to boli zelené guľky. Jeho prirodzenou tendenciou je však vytvárať medzi nimi kovalentné väzby, aby sa dokončili svoje oktety vo Valencii.
Všimnite si, že sotva potrebujú elektrón, aby mali osem valenčných elektrónov, takže tvoria jediný jednoduchý odkaz; To je ten, ktorý sa spája s dvoma atómami CL, aby vytvoril molekulu CL2 (horný obrázok), cl-cl. Preto je chlór v normálnych a/alebo suchozemských podmienkach molekulárny plyn; Non -Monoatomic, ako je to v prípade ušľachtilých plynov.
Intermolekulárne interakcie
Molekula cl2 Je homonukleárny a apolar, takže jeho intermolekulárne interakcie sa riadia disperznými silami v Londýne a jeho molekulárnymi masami. Vo fáze sódy je vzdialenosť CL2-Cl2 Je relatívne krátky v porovnaní s inými plynmi, ktoré, pridali svoju hmotnosť, z neho robí plyn trikrát viac ako vzduch.
Svetlo môže vzrušovať a podporovať elektronické prechody na molekulárnych orbitáloch CL2; V dôsledku toho sa objaví charakteristická žltkastá zelená farba. Táto farba sa zintenzívňuje v stave kvapalného a potom čiastočne zmizne, keď upevňuje.
Môže vám slúžiť: Slabé základneKeď teplota zostupuje (-34 ° C), CL molekuly2 Strácajú kinetickú energiu a vzdialenosť cl2-Cl2 zníženie; Preto sú súdržné a nakoniec definujú tekutý chlór. To isté sa stane, keď je systém (-101 ° C) ďalej ochladený, teraz s molekulami CL2 Takže spolu definuje orcombický kryštál.
Skutočnosť, že existujú kryštály chlóru, naznačuje, že ich disperzné sily sú dostatočne smerové na vytvorenie štrukturálneho vzoru; To znamená, molekulárne vrstvy Cl2. Oddelenie týchto vrstiev je také, že aj pod tlakom 64 GPA je jeho štruktúra modifikovaná, ani nevykazuje elektrickú vodivosť.
Kde je to a získajte
Chloridové soli
 Robustné kryštály Hality, lepšie známe ako bežná alebo stolová soľ. Zdroj: Rodič Géry [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Robustné kryštály Hality, lepšie známe ako bežná alebo stolová soľ. Zdroj: Rodič Géry [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Chlór v plynnom stave sa nenachádza kdekoľvek na povrchu Zeme, pretože je veľmi reaktívny a má tendenciu tvoriť chloridy. Tieto chloridy sú dobre rozložené po celej zemskej kôre a navyše po miliónoch rokov, keď ich ťahajú dažďom, obohacujú more a oceány.
Spomedzi všetkých chloridov je najbežnejšia a najhojnejšia naCl del minerálna halita (vynikajúci obraz); nasledované Silvina, KCL a Carnalita, MGCL Minerals2· Kcl · 6h2Ani. Keď sa voda masy odparia pôsobením slnka, zanechajte za púštne soľné jazerá, z ktorých sa môže NaCl extrahovať priamo ako surovina pre chlór.
Elektrolýza soľanky
NaCl sa rozpustí vo vode a vyrába soľanku (26%), na ktorú je elektrolýza podrobená chlóraralkalínovej bunke. V priehradkách anódy a katódy sa konajú dve semi -reakcie:
2cl-(Ac) => cl2g) + 2e- (Anóda)
2h2Alebo (l) + 2e- => 2OH-(Ac) + h2g) (katódia)
A globálna rovnica pre obe reakcie je:
2NACL (AC) + 2H2Alebo (l) => 2naoh (ac) + h2g) + Cl2g)
Keď dôjde k reakcii, na ióny+ vytvorené v anóde, ktorú migrujú do katódového priehradky, ktorý prechádza priepustnou azbestovou membránou. Z tohto dôvodu je NaOH na pravej strane globálnej rovnice. Oba plyny, CL2 a h2, Zhromažďujú sa z anódy a katódy.
Dolný obrázok ilustruje nové napísané:
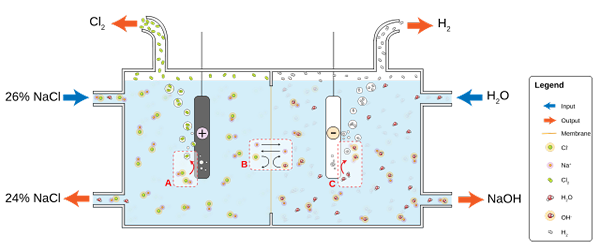 Schéma výroby chlóru prostredníctvom elektrolýzy. Zdroj: jkwchui [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Schéma výroby chlóru prostredníctvom elektrolýzy. Zdroj: jkwchui [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Všimnite si, že koncentrácia soľanky na konci klesá o 2% (trvá z 24 na 26%), čo znamená, že časť jeho CL- originály transformované na molekuly CL2. Industrializácia tohto procesu nakoniec udelila metódu na výrobu chlóru, vodíka a hydroxidu sodného.
Kyslé rozpustenie pyrolusitu
Ako je uvedené v časti História, plynný chlór sa môže produkovať rozpustením vzoriek pyrolusitovej rudy s kyselinou chlorovodíkovou. Nasledujúca chemická rovnica ukazuje produkty získané z reakcie:
Nadnášať2(s) + 4hcl (ac) => mcl2(Ac) + 2h2Alebo (l) + cl2g)
Zliatiny
Neexistujú žiadne zliatiny chlóru z dvoch jednoduchých dôvodov: ich plynné molekuly nemožno zachytiť medzi kovovými kryštálmi a sú tiež veľmi reaktívne, takže by okamžite reagovali s kovmi, aby vytvorili svoj príslušný chlorid.
Na druhej strane, chloridy nie sú žiaduce, pretože akonáhle sa rozpustia vo vode, vyvíjajú fyziologický efekt, ktorý podporuje koróziu v zliatinách; A preto sa kovy rozpustia za vzniku kovových chloridov. Proces korózie pre každú zliatinu je iný; Niektoré sú náchylnejšie ako iné.
Chlór preto nie je pre zliatiny vôbec dobrou prídavkou; ani ako CL2 ani ako Cl- (A atómy by boli veľmi reaktívne, aby mohli dokonca existovať).
Riziká
Aj keď je rozpustnosť chlóru vo vode nízka, stačí na výrobu vlhkosti našej pokožky a oči kyseliny chlorovodíkovej, ktorá končí korodovaním tkanív spôsobujúcich vážne podráždenie a dokonca stratu videnia.
Ešte horšie je dýchať ich žltkasto zelenkavé pary, pretože raz v pľúcach opäť vytvára kyseliny a poškodzuje pľúcne tkanivo. Vďaka tomu človek trpí bolesti v krku, kašeľ a dýchacie ťažkosti z dôvodu tekutín vytvorených v pľúcach.
Ak dôjde k úniku chlóru, čelí obzvlášť nebezpečnej situácii: vzduch nemôže jednoducho „zametať“ svoje pary; Zostaňte tam, kým nereagujú alebo nerozpúšťajú pomaly.
Môže vám slúžiť: Presná rovnováha: Charakteristiky, funkcie, časti, použitiaOkrem toho je to vysoko oxidačná zlúčenina, takže niekoľko látok môže s ním reagovať výbušne k najmenšiemu kontaktu; Rovnako ako s oceľovou vlnou a hliníkom. Preto tam, kde existuje uložený chlór, sa musia vziať všetky potrebné úvahy, aby sa predišlo rizikám požiaru.
Je iróniou, že zatiaľ čo chlór plynný je smrtiaci, jeho anión chloridu nie je toxický; Môže sa konzumovať (s mierou), neopaľuje ani nereaguje s výnimkou fluoridu a iných činidiel.
Žiadosti
Syntéza
Asi 81 % plynného chlóru produkovaného ročne je určené na syntézu organických a anorganických chloridov. V závislosti od stupňa kovalencie týchto zlúčenín sa chlór môže zistiť ako obyčajné atómy CL v chlórovaných organických molekulách (s C-Cl väzbami) alebo ako CL ióny- V niekoľkých chloridových soli (NaCl, CACL2, Mgcl2, atď.).
Každá z týchto zlúčenín má svoje vlastné aplikácie. Napríklad chloroform (CHCL3) a etylchlorid (chlór3Chvály2Cl) sú rozpúšťadlo, ktoré sa používalo ako anestetiká vdýchnutia; Diclorometano (ch2Cl2) a tetrachlorid uhlíka (CCL4), Pokiaľ ide o ich stranu, sú rozpúšťadlá široko používané v laboratóriách organickej chémie.
Ak sú tieto chlórované zlúčeniny tekuté, väčšinou sú určené ako rozpúšťadlá pre organické reakcie znamená.
V iných zlúčeninách predstavuje prítomnosť atómov chlóru zvýšenie v dipólovom okamihu, takže môžu vo väčšej miere interagovať s polárnou matricou; tvorené proteínmi, aminokyselinami, nukleovými kyselinami atď., biomolekuly. Chlór má teda aj papier v syntéze liekov, pesticídov, insekticídov, fungicídov atď.
Pokiaľ ide o anorganické chloridy, zvyčajne sa používajú ako katalyzátory, surovina na získanie kovov elektrolýzou alebo zdrojmi iónov CL-.
Biologický
Plynný alebo elementárny chlór nemá v živých bytostiach žiadnu úlohu viac ako ničenie ich tkanív. To však neznamená, že ich atómy nemožno nájsť v tele. Napríklad CL ióny- Sú veľmi hojné v bunkovom a extracelulárnom médiu a pomáhajú kontrolovať hladiny iónov+ a ca2+, hlavne.
Podobne je kyselina chlorovodíková súčasťou žalúdočnej šťavy, s ktorou sa jedlo strávi v žalúdku; jeho CL ióny-, V spoločnosti H3Ani+, Definujte pH takmer 1 z týchto sekrétov.
Chemické zbrane
Hustota plynného chlóru z nej robí smrtiacu látku, keď sa vyliaje alebo naleje do zatvorených alebo otvorených priestorov. Byť hustejší ako vzduch, jeho prúd sa ľahko netiahne chlór, takže zostane na značnú dobu, kým sa konečne rozptýli.
Napríklad v prvej svetovej vojne sa tento chlór použil na bojiskách. Po prepustení sa vkradol do zákopov, aby dusil vojakov a prinútil ich ísť na povrch.
Dezinfekčný prostriedok
 Bazény sú chlóronizované, aby sa predišlo reprodukcii a šíreniu mikroorganizmov. Zdroj: Pixabay.
Bazény sú chlóronizované, aby sa predišlo reprodukcii a šíreniu mikroorganizmov. Zdroj: Pixabay. Chloronizované roztoky, tie, kde sa rozpustil plynný chlór vo vode a potom sa alkalilizoval pufrom, majú vynikajúce dezinfekčné vlastnosti, ako aj inhibujú hnilobu tkanív tkanív. Boli použité na dezinfekciu otvorených rán na odstránenie patogénnych baktérií.
Voda pri bazéne je presne chloronizovaná, aby sa eliminovali baktérie, mikróby a parazity, ktoré ju môžu umiestniť. Na tento účel sa používal plynný chlór, ale jeho pôsobenie je dosť agresívne. Namiesto toho sa používajú roztoky chlórnanu sodného (bielidlo) alebo kyselina trichlórizocianurová (ATC) (ATC).
Predchádzajúce ukazuje, že to nie je CL2 Ten, kto vyvíja dezinfekčný účinok, ale kyselinu HCLO, kyselinu hypochloritov, ktorá produkuje radikály alebo ·, ktoré ničia mikroorganizmy.
Bielenie
Chlór veľmi podobný jeho dezinfekčnému pôsobeniu tiež bieli materiály, pretože farby zodpovedné za HCLO. Jeho chlóronizované roztoky sú teda ideálne na odstránenie miest z bielych odevov alebo na bielidlo papierovej buničiny.
Polyvinylchlorid
Najdôležitejšou chlórovanou zlúčeninou zo všetkých, pre ktorú sa prideľuje asi 19% zostávajúcej produkcie plynného chlóru, je vinylly polychlorid (PVC). Tento plast má viacnásobné použitie. Vďaka nim sa vyrábajú vodné potrubia, rámy okien, steny stien a podláh, elektrické zapojenie, intravenózne vrecká, kabáty atď.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Chlór. Zdroj: In.Wikipedia.orgán
- Laura H. a kol. (2018). Štruktúra tuhého chlóru pri 1.45 gpazeitschrift für Kristallgraphie. Kryštalické materiály, zväzok 234, vydanie 4, strany 277-280, ISSN (online) 2196-7105, ISSN (tlač) 2194-4946, doi: doi.org/10.1515/ZKRI-2018-2145
- Národné centrum pre biotechnologické informácie. (2019). Chlór. Databáza pubchem. CID = 24526. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Marques Miguel. (s.F.). Chlór. Získané z: Nautilus.Fis.Uc.Pt
- Americká rada pre chémiu. (2019). Chlórová chémia: Úvod do chlóru. Získané z: chlóru.Americký.com
- Fong-yan ma. (s.F.). Korozívne účinky chloridov na kovy. Oddelenie námorného inžinierstva, Čínska republika NTou (Taiwan).
- Štát New York. (2019). Fakty o chlóru. Získané z: zdravia.Ny.Vláda
- DR. Doug Stewart. (2019). Fakty chlórskeho prvku. Chemickolák. Získané z: Chemicool.com

