Štruktúra citranu sodného (C6H5O7NA3), použitie, vlastnosti
- 3890
- 804
- Ing. Ervín Petruška
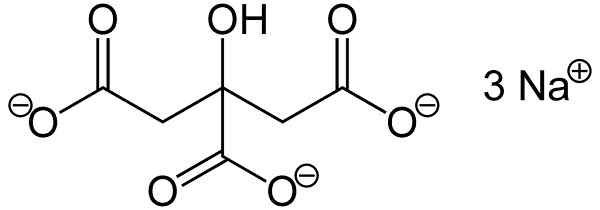
On citrát sodný Je to sodná soľ kyseliny citrónovej. Je tvorený anión citrát C6H5Ani73- a tri katióny sodíka+. Jeho molekulárny vzorec je C6H5Ani7Nat3 alebo vo svojej rozšírenej podobe: Naooc-CH2-C (agone) (OH) -ch2-Cesta. Citrát sodný je konjugovanou základňou kyseliny citrónovej, to znamená, že sa z nich získava nahradením každého protónu h+ z -cooh pre sodný kývnutie+.
Môže sa pripraviť v anhydre (bez vody v jej zložení) alebo v hydratovanom tvare s 2 alebo 5 molekulami vody. Je to zlúčenina, ktorá, keď bezvodý (bez vody) má tendenciu absorbovať vodu z životného prostredia.
 Molekula citrátu trisodia. Autor: Marilú Stea.
Molekula citrátu trisodia. Autor: Marilú Stea. Citrát sodný pôsobí ako tlmivý roztok, čo znamená, že pH sa stabilizuje, čo je miera kyslosti alebo zásaditosti vodného roztoku. Má tiež vlastnosť vytvorenia stabilnej zlúčeniny s vápnikovými iónmi CA2+, Citrát.
Používa sa napríklad v potravinárskom priemysle, aby sa predišlo tomu, že kravské mlieko tvorí hrudky ťažko stráviteľné dojčatami.
V laboratóriách bioanalýzy sa používa na zabránenie koagulovanej krvi, že pacienti sú extrahovaní na určité testy. Zabraňuje aj v koagulácii krvi používanej v transfúziách. Sa široko používa vo fosfátových detergentoch, pretože to nie je znečisťujúce.
[TOC]
Štruktúra
Trisodio citrát sa skladá z troch iónov sodíkov+ a citrátový ión.
Citrátový ión sa skladá z reťazca troch atómov uhlíka, na ktoré sú 3 karboxyláty zjednotené- (jeden pre každý atóm uhlíka) a hydroxyl -oh v centrálnom uhlíku.
Každý z 3 iónov NA+ je spojený so skupinou -Coo-.
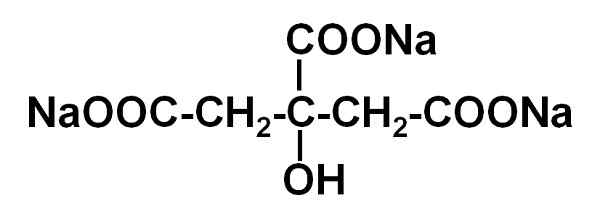
 Štruktúra citrátu trisodia. Jü [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra citrátu trisodia. Jü [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
- Citrát sodný
- Trisodio citrát
- 2-hydroxipropán-1,2,3-trikarboxylát trisodium
Vlastnosti
Fyzický stav
Biela alebo bezfarebná kryštalická pevná látka.
Molekulová hmotnosť
258,07 g/mol
Bod topenia
300 ° C
Rozpustnosť
Je veľmi rozpustný vo vode: 42,5 g/100 ml pri 25 ° C. Je prakticky nerozpustný v alkoholu.
pH
Vodný roztok na 5% citrát sodný má pH medzi 7,5 a 9,0, to znamená, že je mierne zásaditý.
Chemické vlastnosti
Citrát sodný je tlmivý roztok, čo znamená, že stabilizuje pH, čo je miera kyslosti alebo alkality vodného roztoku. Citrát pri stabilizácii pH neumožňuje okyslenie roztoku alebo alkalizácie nad určitými hodnotami.
Môže vám slúžiť: Elektronická konfigurácia jadra: konštrukcia, príkladyKeď sú prebytočné protóny h+ Beriem ich na konverziu ich skupín -COO- V skupinách -coh. Naopak, ak existuje veľa OH skupín- poskytuje protóny svojich skupín -coh a robí z nich -Coo-.
Pri transformácii telom poskytuje 3 molekuly HCO3- Pre každú molekulu citrátu.
Ďalšie vlastnosti
Jeho kryštály sú vynikajúce, to znamená, že absorbujú vzduch zo vzduchu. Dihydratovaný citrát sodný je vo vzduchu stabilnejší.
Ak sa dihydrát zahrieva, keď dosiahne 150 ° C, stane sa bezvodým (bez vody).
Rovnako ako kyselina citón, citrát sodný má kyslú chuť.
Získanie
Citrát sodný sa zvyčajne získa pridaním uhličitanu sodného do roztoku kyseliny citrónovej, kým šumivo neprestane. Efervescencia je spôsobená oddelením oxidu uhličitého2:
Nat2Co3 + Kyselina citrónová → citrát sodný + CO2↑
Potom sa voda roztoku odparuje na kryštalizáciu produktu.
Môže sa tiež pripraviť ošetrením roztoku síranu sodného s citranom vápenatého:
Nat2SW4 + Citrate vápenatý → Citrate sodný + puzdro4↓
Roztok sa filtruje na odstránenie puzdra4 Pevná látka, ktorá sa vyzrážala. Potom je roztok koncentrovaný, a tak kryštalizuje citrát sodný.
Miesto v prírode
Citrát sodný je konjugovaná základňa kyseliny citrónovej, ktorá je prírodnou zlúčeninou nachádzajúcou sa vo všetkých živých organizmoch, pretože je súčasťou jeho metabolizmu, ktorý je mechanizmom na vývoj energie v bunkách.
Žiadosti
V potravinárskom priemysle
Citrát sodný má rôzne využitie v potravinárskom priemysle, napríklad ako regulátor kyslosti, únosu, stabilizátora, činidlo povrchovo aktívnej látky alebo emulgátora.
Používa sa okrem iného v nápojoch, mrazených dezertoch a špeciálnych syroch.
Umožňuje vyhnúť sa koagulácii mlieka, takže sa pridáva do kravského mlieka používaného na kŕmenie dojčiat. Týmto spôsobom nie sú žiadne koagy alebo tvrdé -diigest kučery, ktoré sa vytvárajú žalúdkom najmenších.
 Do mlieka môžete pridať citrát sodný, aby sa v žalúdku nevytvorili hrudky. Autor: Couleur. Zdroj: Pixabay.
Do mlieka môžete pridať citrát sodný, aby sa v žalúdku nevytvorili hrudky. Autor: Couleur. Zdroj: Pixabay. Používa sa na urýchlenie fixovania farieb v bravčovom mäse alebo vyliečených vakcínach, to znamená ošetrené mäso, aby sa predišlo jeho rozkladu. V týchto sa nahradí až 50% kyselina askorbová.
Môže vám slúžiť: kyselina kremičitá Mäso vytvrdené z bravčového mäsa, ktoré pravdepodobne obsahuje citrát sodný. Autor: Ben Kerckx. Zdroj: Pixabay.
Mäso vytvrdené z bravčového mäsa, ktoré pravdepodobne obsahuje citrát sodný. Autor: Ben Kerckx. Zdroj: Pixabay. Slúži tiež na prevenciu koagulácie krvi v čerstvom vakcínovom mäse (napríklad steaky).
V medicíne
Používa sa ako alkalizačné činidlo, pretože neutralizuje prebytočnú kyselinu v krvi a moči. Je indikované na liečbu metabolickej acidózy, ktorá sa vyskytuje, keď telo produkuje príliš veľa kyslého.
Akonáhle je citrátový ión požitý, stáva sa hydrogenuhličitanovým iónom, ktorý je systémovým alkalizačným činidlom (tj celé telo) a v dôsledku toho ióny H neutralizujú+, Zvyšuje pH krvi a vracia sa alebo eliminuje acidózu.
Citrát sodný slúži ako neutralizujúce činidlo pre nepohodlie žalúdka.
Používa sa ako expektorant a pot. Má diuretické pôsobenie. Zvýšte vylučovanie vápnika moču, ktorá sa používa pri hyperkalciémii, čo je v prípade, že v krvi je nadbytok vápnika.
Slúži tiež na uľahčenie eliminácie olova pri otrave týmto kovom.
Ak sa podáva prebytok, môže sa produkovať alkalóza, spazmy svalov.
Citrát sodný sa používa v transfúziách. Pridá sa do krvi spolu s dextrózou, aby sa predišlo jej koagulácii.
 Uložená krv pre transfúzie. Pravdepodobne obsahuje citrát sodný. Autor: Kshirl02. Zdroj: Pixabay.
Uložená krv pre transfúzie. Pravdepodobne obsahuje citrát sodný. Autor: Kshirl02. Zdroj: Pixabay. Normálne pečeň rýchlo metabolizuje citrát získaný v transfúzii, avšak počas transfúzií veľkých množstiev je možné prekročiť kapacitu pečene.
V takýchto prípadoch, pretože citrát tvorí komplex s vápnikom, je to zníženie CA vápnikového iónu2+ v krvi. To môže generovať omráčenie, chvenie, brnenie atď. Preto sa musia transfúzie vykonávať pomaly.
Vo farmaceutickom priemysle
Medzi mnohými inými použitia sa používa na zabránenie stmavnutia liekov, v ktorých sú železo a triesloviny.
Pri analýze krvi
Používa sa ako antikoagulant pri zbere krvi alebo keď by sa mal skladovať, pretože pôsobí ako vápnikový hrudník CA2+, to znamená, že sa viaže na vápnikové ióny tvoriace citrát vápnika, ktorý nie je ionizovaný.
Môže vám slúžiť: iónový odkaz: Charakteristiky, ako sa formuje a príkladyPoužíva sa v koagulačných testoch a pri určovaní rýchlosti sedimentácie červených krviniek.
 Krvný test. Autor: Bokskopet. Zdroj: Pixabay.
Krvný test. Autor: Bokskopet. Zdroj: Pixabay. Používa sa ako antikoagulant počas plazmaferézy, postup na extrahovanie z nadbytočných látok krvi škodlivé pre telo.
V syntéze nanočastíc
Používa sa ako stabilizátor v syntéze nanočastíc zlata. Pridá sa Trisodio Citrate Dihydratovaný do kyseliny chlóhovej, čím sa vytvára suspenzia červeného vína.
Citrát sodný slúži ako redukčné činidlo a ako anti -regiálne činidlo, pretože je adsorbovaný na nanočasticiach.
Kvôli zápornému zaťaženiu citrátu sa častice odpudzujú jeden spolu, aby sa predišlo a tvorili stabilnú disperziu. Čím vyššia je najmenšia koncentrácia citrátu, sú častice.
Tieto nanočastice slúžia na prípravu lekárskych biosenzorov.
V environmentálnych detergentoch
Citrát sodný sa široko používa vo fosfátových kvapalných detergentoch. Je to preto, že jeho environmentálne správanie je neškodné, pretože je to metabolit nachádzajúci sa vo všetkých živých organizmoch.
Je ľahko biologicky odbúrateľná a slabo toxická pre vodný život. Z tohto dôvodu sa predpokladá, že ide o čistiaci prostriedok s ekologicky priaznivými charakteristikami.
Pri zlepšovaní využívania bitúmenových pieskov
Bitúmenové piesky sú piesočnaté útvary bohaté na bitúmen alebo decht, materiál podobný oleju.
Citrát sodný bol úspešne testovaný spolu s hydroxidom sodným NaOH na extrahovanie oleja z bitúmenových pieskov.
Predpokladá sa, že keď citrát s pieskovcom, ióny -Coo- citrátu tvorí veľké množstvo záporných zaťažení na časticiach oxidu kremičitého. To vytvára lepšie oddelenie piesku od bitúmenu jednoduchým odpudzovaním negatívnych zaťažení štrku negatívneho zaťaženia bitúmenu.
V iných aplikáciách
Používa sa vo fotografii, na odstránenie stopových kovov, v elektrodepozícii a na odstránenie2 zvyškových plynov.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Citrát sodný. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- McNamara, C. (2017). Zbierka a manipulácia s krvou. V Dacie a Lewis Praktickej hematológii (dvanáste vydanie). Zotavené z vedeckých pracovníkov.com.
- Steber, J. (2007). Ekotoxicita prísad čistiaceho produktu. V príručke na čistenie/dekontamináciu povrchov. Zotavené z vedeckých pracovníkov.com.
- Xiang, b. a kol. (2019). Štúdium úlohy citrátu sodného v oslobodení bitúmenu. Energy Fuels 2019, 33, 8271-8278. Získané z krčiem.ACS.orgán.
- Heddle, n. A Webert, K.A. (2007). Transfúzia medicíny. V krvnom bankovníctve a transfúznej medicíne (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Sudhakar, s. a Santhosh, P.B. (2017). Zlaté nanomateriály. V pokrokoch v biomembránov a samostatných lipidoch. Zotavené z vedeckých pracovníkov.com.
- Elsevier (redakcia) (2018). Kapitola 8. Nanometálny. Vo fondoch a aplikáciách nano kremíka v plazmonike a plných látkach. Súčasné a budúce trendy mikro a nano technológie. Strany 169-203. Zotavené z vedeckých pracovníkov.com.

