Cysteínové charakteristiky, štruktúra, funkcie, biosyntéza
- 2292
- 608
- Alan Milota
Ten Cysteín (Cys, c) je jedným z 22 aminokyselín nachádzajúcich sa v prírode ako súčasť polypeptidových reťazcov, ktoré tvoria proteíny živých bytostí. Je nevyhnutné pre stabilitu terciárnych štruktúr proteínov, pretože pomáha tvorbe intramolekulárnych disulfidových mostov.
Rovnako ako to platí pre iné aminokyseliny, ako je alanín, arginín, asparagín, glutamát a glutamín, glycín, prolín, serín a tyrozín, ľudské bytosti sú schopné syntetizovať cysteín.
 Cysteínová aminokyselina (zdroj: Hattrich [verejná doména] cez Wikimedia Commons)
Cysteínová aminokyselina (zdroj: Hattrich [verejná doména] cez Wikimedia Commons) Napriek tomu a vzhľadom na skutočnosť, že miery syntézy nie vždy dodávajú požiadavky na telo, niektorí autori opisujú cysteín ako „podmienečne“ aminokyselinu.
Táto aminokyselina bola pomenovaná „cystina“, súčasť vezikulárnych výpočtov objavených v roku 1810, ktorej meno bolo vytvorené v roku 1832 a. Baudrimont a f. Maguti. O niekoľko rokov neskôr, v roku 1884 a. Baumann zistil, že cysteín bol produktom redukcie cystínu.
Po práci, ktorú vykonal Bauman, v roku 1899 sa zistilo, že cysteín je hlavnou zložkou proteínu, ktorý tvorí rohy rôznych zvierat, čo naznačovalo jeho možné použitie na syntézu polypeptidov.
V súčasnosti je známe, že cysteín tela pochádza z potravín, recyklácie bielkovín a endogénnej syntézy, ktorá sa vyskytuje hlavne v hepatocytoch.
[TOC]
Charakteristika
Cysteín má molekulovú hmotnosť 121.16 g/mol a nachádza sa spolu s leucínom, izoleucínom, valínom, fenylalanínom, tryptofánom, metionínom a tyrozínom, medzi najviac hydrofóbnymi aminokyselinami.
Patrí do skupiny polárnych aminokyselín bez zaťaženia a rovnako ako iné aminokyseliny, môže sa degradovať alkalickou hydrolýzou pri vysokých teplotách.
Rovnako ako tryptofán, serín, glycín a treonín, cysteín je metabolický prekurzor glukoneogenézy a ketogenézy (tvorba ketónových teliesok).
Táto aminokyselina existuje ako súčasť peptidovej sekvencie proteínov, ale môže byť tiež voľná v krvnej plazme ako homogénne disulfidy (cystín, derivát) alebo zmiešané, zložené z formy homocysteínu-cysteínu.
Hlavný rozdiel medzi voľným cysteínom a tým, ktorý sa nachádza v proteínovej štruktúre, je to, že prvý je vo veľmi hrdzavom redoxnom stave, zatiaľ čo posledný je zvyčajne celkom znížený.
Štruktúra
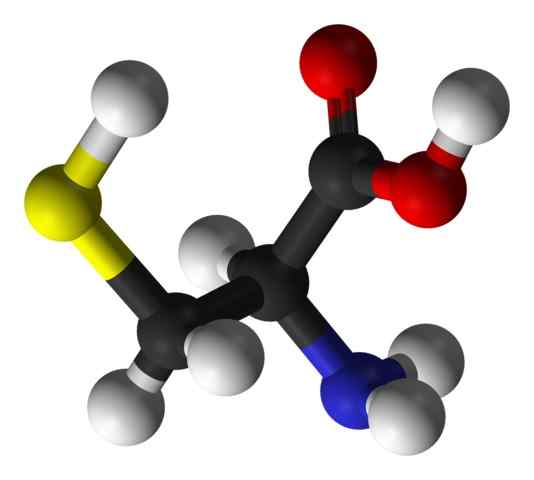
Rovnako ako v prípade zvyšných aminokyselín opísaných doteraz, cysteín má centrálny atóm uhlíka, ktorý je chirálny a je známy ako uhlík a.
K tomuto atómu uhlíka sú spojené štyri rôzne chemické druhy:
- Aminoskupina (-NH3+)
- Karboxylová skupina (-Co-)
- atóm vodíka a
- Substituent (-r).
Substituent Group je skupina, ktorá dáva identitu každej aminokyseline a cysteín sa vyznačuje obsahom atómu síry ako súčasť skupiny Klenot ani Sulfhydrillo (-Ch2-sh).

Je to táto skupina, ktorá jej umožňuje zúčastňovať sa na tvorbe intramolekulárnych disulfidových mostov. Pretože ide o nukleofil, môžete sa tiež zúčastniť na substitučných reakciách.
V skutočnosti je možné tento bočný reťazec cysteínu modifikovať na tvorbu dvoch zlúčenín známych ako „selenocysteín“ a „lantionín“. Prvou je aminokyselina, ktorá sa tiež podieľa na tvorbe proteínov a druhá je derivát aminokyselinového aminokyselinového aminokyselinového aminokyselinového.
Môže vám slúžiť: Históny: Charakteristiky, štruktúra, typy a funkcieSkupina cysteínu Tiol sa tiež vyznačuje svojou veľkou afinitou k striebrom a iónom ortuti (Ag+ a Hg2+).
Funkcia
Hlavné funkcie cysteínu v živých organizmoch súvisia s ich účasťou na tvorbe proteínov. Konkrétne sa cysteín podieľa na vytvorení disulfidových mostov, ktoré sú nevyhnutné na tvorbu štruktúry terciárneho proteínu.
Okrem toho je táto aminokyselina užitočná nielen pre syntézu proteínov, ale tiež sa podieľa na syntéze glutatiónu (GSH) a poskytuje redukovanú síru pre metionín, kyselinu lipoovú, tiamín, koenzým A (COA), molybdopterín (Cofaktor) a iným zlúčeniny s biologickým významom.
V podmienkach nadmerného množstva sírových aminokyselín sa môže cysteín a ďalšie príbuzné aminokyseliny použiť na produkciu anorganického pyruvátu a síry. Pyruvát sa dokáže presmerovať smerom k gluconeogénnej trase, slúži na výrobu glukózy.
Keratíny, ktoré sú jedným z najhojnejších typov štrukturálnych proteínov v živočíšnom kráľovstve, sú bohaté na zvyšky cysteínu. Napríklad ovčie vlna obsahuje viac ako 4% síry z tejto aminokyseliny.
Cysteín sa tiež podieľa na mnohých reakciách oxidu redukcie, takže je súčasťou aktívneho miesta niektorých enzýmov.
Pri reagovaní s glukózou táto aminokyselina vytvára reakčné produkty, ktoré predstavujú atraktívne chute a arómy pre niektoré kulinárske prípravky.
Biosyntéza
Biosyntéza aminokyselín v ľudskom tele a v oblasti iných zvierat (cicavcov a nemaloch) sa koná v tkanivovej forme a triedu buniek; Je to proces, ktorý si zaslúži energiu a zvyčajne sa oddeľuje medzi rôznymi orgánmi.
Pečeň je jedným z hlavných orgánov zapojených do syntézy najviac neosenciálnych aminokyselín, bez ohľadu na uvažované druhy.
V tomto je nielen cysteín syntetizovaný, ale aj aspartát, asparagín, glutamát a glutamín, glycín, serín, tyrozín a ďalšie z jeho špecifických prekurzorov aminokyselín.
V roku 1935 značka Erwin zistila, že cysteín u cicavcov je prirodzene syntetizovaný z metionínu, ktorý sa uskutočňuje výlučne v pečeňovom tkanive.
Tento proces sa môže vyskytnúť v dôsledku „transmetilu“ metionínu, kde sa metylové skupiny prenášajú na kopec a kreatín. Cysteín však môže byť tiež vytvorený z metionínu vďaka transulfurácii.
Následne sa preukázalo, že okrem metionínu sú niektoré syntetické zlúčeniny, ako je N-acetyl cysteín, cysteamín a cystamín, užitočné prekurzory pre syntézu cysteínu.
V prípade N-acetyl cysteínu to berú bunky, kde sa premieňa na cysteín enzýmom cytosolu v cytosóle.
Mechanizmus syntézy
Mechanizmus syntézy cysteínu z najznámejšej metódy je mechanizmus trans -ululo. K tomu dochádza hlavne v pečeni, ale bolo tiež určené v čreve a pankrease.
K tomu dochádza z homocysteínu, zlúčeniny odvodenej z aminokyselinovej metódy; A prvou reakciou tejto biosyntetickej cesty je kondenzačná katalyzovaná enzýmom p-Sentázy (CBS) (CBS).
Môže vám slúžiť: Uracil: Štruktúra, funkcie, vlastnosti, syntézaTento enzým predstavuje prechod „záväzku“ trasy a kondenzuje homocysteín serínovým zvyškom, ďalšou proteínovou aminokyselinou, ktorá produkuje cystationín. Následne je táto zlúčenina „vyrezaná“ alebo „rozdelená“ enzýmom cistationasa, čo vedie k uvoľňovaniu cysteínu.
Regulácia enzymatickej aktivity CBS je sprostredkovaná dostupnosťou metódy a redoxným stavom bunky, kde sa tento proces vyskytuje.
Prostredníctvom trasy syntézy cysteínu dokáže bunky zvládnuť nadbytok metódy, pretože ich konverzia na cysteín je nezvratný proces.
Syntéza cysteínu v rastlinách a mikroorganizmoch
V týchto organizmoch je cysteín syntetizovaný hlavne z anorganickej síry, ktorá je najhojnejším zdrojom použiteľnej síry v aeróbnej biosfére.
Toto sa berie, vstupuje do buniek a potom sa redukuje na sulfid (S2-), ktorý je začlenený do cysteínu podobným spôsobom ako to, čo sa deje s amoniakom v syntéze glutamátu alebo glutamín.
Metabolizmus a degradácia
Katabolizmus cysteín sa vyskytuje hlavne v pečeňových bunkách (hepatocyty), hoci sa môže vyskytnúť aj v iných typoch buniek, ako sú neuróny, endoteliálne bunky a bunky hladkého svalstva vaskulatúry tela.
Určité defekty v katabolizme cysteínu vyvolávajú dedičné ochorenie známe ako „cystinúria“, charakterizované prítomnosťou cystínových výpočtov v obličkách, močovom mechúre a močovodu.
Cystín je aminokyselina odvodená z cysteínu a výpočty sú tvorené spojením dvoch molekúl prostredníctvom atómov síry.
Časť metabolizmu cysteínu vedie k tvorbe vedeckej kyseliny, z ktorej sa tvorí býčie zápasy, nekonečná aminokyselina. Reakcia je katalyzovaná enzýmom cysteín dioxigenasa.
Cysteín sa navyše môže oxidovať formaldehydom, aby sa vytvoril cysteín N-formil, ktorého následné spracovanie môže viesť k tvorbe „tovaru“ (produkt kondenzácie cysteínov s aromatickými zlúčeninami).
U zvierat sa používa aj cysteín, ako aj glutamát a glutamín na syntézu koenzýmu A, glutatiónu (GSH), pyruvátu, sulfátu a kyseliny sulfiderovej.
Jedna z metód konverzie z cysteínu na pyruvát sa vyskytuje v dvoch krokoch: prvá naznačuje odstránenie atómu síry a druhú transaminačnú reakciu.
Obličky sú zodpovedné za vylučovanie síranov a sulfit odvodených z metabolizmu zlúčenín síry, ako je cysteín, zatiaľ čo pľúca výdychom oxidu siričitého a kyseliny sulfidovej kyseliny sulfidovej.
Glutatión
Glutatión, molekula tvorená trom aminokyselinovým odpadom (glycín, glutamát a cysteín) je molekula, ktorá je prítomná v rastlinách, zvieratách a baktériách.
Má špeciálne vlastnosti, vďaka ktorým je vynikajúcou redoxnou „tlmivým roztokom“, pretože chráni bunky pred rôznymi typmi oxidačného stresu.
Potraviny bohaté na cysteín
Cysteín sa prirodzene vyskytuje v potravinách, ktoré obsahujú síru ako žĺtky (žlté) vajec, červených papriky, cesnaku, cibule, brokolice, karfiolu, zrážky, kolili a cholných choll.
Je tiež prítomný väčšinou v potravinách bohatých na bielkoviny, ako sú mäso, strukoviny a mliečne výrobky, medzi ktoré patria:
Môže vám slúžiť: ovalbumín: štruktúra, funkcie, denaturácia- Kravské mäso, bravčové mäso, kuracie mäso a ryby
- Ovos a šošovica
- Slnečnicové semienka
- Jogurt a syr
Výhody príjmu cysteínu
Predpokladá sa, že jeho príjem zabraňuje vypadávaniu vlasov a stimuluje jej rast. V potravinárskom priemysle sa veľmi používa ako panifiabilný masážny agent a tiež „reprodukovať“ chute podobné mäsu.
Iní autori zdôraznili, že príjem doplnkov výživy alebo potravín -bohaté potraviny sa znižujú.
Niektoré výživové doplnky týkajúce sa cysteínu používajú ľudské bytosti ako antioxidanty, ktoré sa považujú za prospešné z hľadiska „oneskorenia“ starnutia.
Napríklad N-acetylcysteín (prekurzor v syntéze cysteínu) sa považuje za výživový doplnok, pretože to vedie k zvýšeniu biosyntézy glutatiónu (GSH).
Súvisiace choroby
Existuje niekoľko vedeckých publikácií, ktoré spájajú vysoké hladiny plazmatického cysteínu s obezitou a inými súvisiacimi patológiami, ako sú kardiovaskulárne choroby a iné metabolické syndrómy.
Cystinúria, ako je uvedené vyššie, je patológia, ktorá súvisí s prítomnosťou cystínových kameňov, derivátu zipsov, v dôsledku genetického defektu v reabsorpcii dibázických aminokyselín, ako je napríklad cystín.
Poruchy nedostatku
Nedostatok cysteínu súvisí s oxidačným stresom, pretože je to jeden z hlavných prekurzorov syntézy glutatiónu. Preto nedostatky v tejto aminokyseline môžu viesť k predčasnému starnutiu a všetkým bytom, ktoré to znamená.
Experimentálne sa preukázalo, že suplementácia cysteínu zlepšuje funkcie kostrového svalu, znižuje vzťah medzi tukovou a non -FAT telesnou hmotnosťou, znižuje plazmatické hladiny zápalových cytokínov, zlepšuje funkcie imunitného systému atď.
V polovici 90. rokov niektoré štúdie naznačujú, že získaný syndróm imunodeficiencie (AIDS) by mohol byť dôsledkom nedostatku cysteínu vyvolaného vírusom vírusom.
Tieto vyhlásenia boli podporené skutočnosťou, že vyšetrení pacienti s pozitívnymi hi mali nízku hladinu cystínu a cysteínu v plazme, okrem znížených intracelulárnych koncentrácií glutatiónu.
Odkazy
- Dröge, W. (1993). Cysteín a glutatión deficitu. Farmakológia, 46, 61-65.
- Dröge, W. (2005). Oxidačný stres a starnutie: Starne syndróm cysteínovej deficitu? Filozofické transakcie Kráľovskej spoločnosti B: Biologické vedy, 360(1464), 2355-2372.
- Elshorbagy, a. Klimatizovať., Smith, a. D., Kozich, v., & Refsum, h. (2011). Cysteín a obezita. Obezita, dvadsať(3), 1-9.
- Kridich, n. (2013). Biosyntéza cysteínu. Ecosal Plus, 1-30.
- McPherson, r. Do., & Hardy, G. (2011). Klinické a výživové prínosy doplnkov obohatených k cysteínom. Súčasný názor na klinickú výživu a metabolickú starostlivosť, 14, 562-568.
- Mokhtari, V., Afsharian, str., Shahhoseini, m., Kalantar, s. M., & Moini, a. (2017). Preskúmanie rôznych použití N-acetyl cysteínu. Denník, 19(1), 11-17.
- Piste, P. (2013). Antioxidant cysteín. Medzinárodný denník farmaceutických, chemických a biologických vied, 3(1), 143-149.
- Quig, d. (1998). Metabolizmus cysteínu a toxicita kovu. Preskúmanie alternatívnej medicíny, 3(4), 262-270.
- Wu, g. (2013). Aminininokyseliny. Biochémia a výživa. Boca Raton, FL: Taylor & Francis Group.
- « Charakteristiky sociálneho vzdelávania, teória bandura, príklady
- Sociálno -emocionálne rozmery vzdelávania, význam, predškolská škola »

