Kyselina
- 2288
- 710
- Alfréd Blaho
 Kyselina sírna je minerálna kyselina, ktorá sa vyskytuje, keď sa oxid siričitý rozpustí vo vode
Kyselina sírna je minerálna kyselina, ktorá sa vyskytuje, keď sa oxid siričitý rozpustí vo vode Čo je kyselina sírna?
On Kyselina Je to oxácido, ktorý sa tvorí pri oxidu siričitého, takže2, rozpúšťa sa vo vode. Je to slabá a nestabilná kyselina anorganická, ktorá sa nedala detegovať v roztoku, pretože reakcia jeho tvorby je reverzibilná a kyselina sa rýchlo rozkladá v činidlách, ktoré ju produkovali (tak2 a h₂o).
Je to bezfarebná tekutina so silnou vôňou síry, nestabilná a používa sa v rôznych priemyselných oblastiach, ako sú materiály zafarbené chlórmi, pre syntézu liečivých a chemických výrobkov, na výrobu papiera alebo na vylepšenie derivátov ropy.
Molekula kyseliny síry sa v súčasnosti detegovala iba v plynnej fáze. Konjugované základy tejto kyseliny sú bežné anióny vo forme sulfit a bisulfitu.
Ramanovo spektrum So So2 Vykazuje iba príznaky v dôsledku molekuly SO2 a bisulfitový ión, HSO3-, v súlade s nasledujúcou rovnovážou:
SW2 + HSO HSO3- + H+
To naznačuje, že Ramanovým spektrom to nie je možné.
Pri vystavení atmosfére sa rýchlo transformuje na kyselinu sírovú. Kyselina sírová kyselina sa redukuje na sírovodík v dôsledku pôsobenia zriedenej kyseliny sírovej a zinku.
Pokus o sústredenie roztoku SO2 Odparením vody na získanie kyseliny síry bez vody, nepriniesla výsledok, pretože kyselina sa rýchlo rozkladá (investovanie tvorivej reakcie), takže kyselina nemožno izolovať.
Štruktúra Kyselina
 Chemická štruktúra kyseliny sírovej
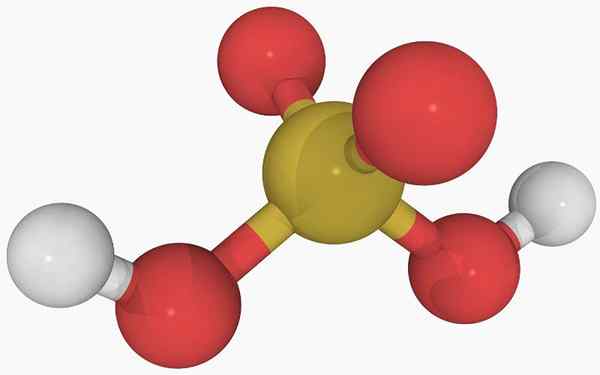
Chemická štruktúra kyseliny sírovej Na hlavnom obrázku je možné vidieť štruktúru izolovanej molekuly kyseliny sírovej v plynnom stave. Žltá guľa v strede zodpovedá atómu síry, červené atómy kyslíka a biele k vodíkom.
Môže vám slúžiť: DiastreoméryJeho molekulárna geometria okolo atómu S je trigonálna pyramída, s atómami alebo kreslením základne.
Potom, v plynnom stave, H molekuly2SW3 Môžu sa považovať za mikroskopické trigonálne pyramídy plávajúce vo vzduchu, za predpokladu, že sú dostatočne stabilné na to, aby vydržali nejaký čas bez toho, aby reagovali.
Štruktúra objasňuje, odkiaľ pochádzajú dva kyslé hydrogény: z hydroxylových skupín spojených so síry, ho-oh-oh-oh. Preto pre túto zlúčeninu nie je správne predpokladať, že jeden z kyslých protónov, h+, sa uvoľňuje z atómu síry, H-So2(Oh).
Dve skupiny OH umožňujú kyseline síry interagovať pomocou vodíkových mostov a tiež kyslík väzby S = o je akceptor vodíka, ktorý vyrába H2SW3 v dobrom darcovi a akceptorovi týchto mostov.
Podľa vyššie uvedeného, h2SW3 Mal by som byť schopný kondenzovať v kvapaline, ako to robí kyselina sírová, h2SW4. Napriek tomu tak nie je to, ako sa to stáva.
Fyzikálne a chemické vlastnosti Kyselina
Molekulárna receptúra
H2SW3
Molekulová hmotnosť
82.073 g/mol.
Fyzický vzhľad
Je to bezfarebná tekutina s pikantnou vôňou síry.
Hustota
1.03 g/ml.
Hustota pary
2.3 (vo vzťahu k vzduchu, ktorý sa berie ako 1)
Kričanie
Je to korozívne pre kovy a tkanivá.
Rozpustnosť
Mizerný.
Citlivosť
Je citlivý na vzduch.
Stabilita
Stabilný, ale nezlučiteľný so silnými základňami.
Kyslosť konštanta (ka)
1.54 x 10-2
Pka
1.81
pH
1.5 na stupnici pH.
zapaľovač
Nie horľavý.
Rozklad
Pri zahrievaní sa môže kyselina síra rozdeliť a emitovať toxický dym oxidu síry.
Môže vám slúžiť: chrómový hydroxid: štruktúra, vlastnosti, syntéza, použitieMenovanie
Síra má nasledujúce valencie: ± 2, +4 a +6. Z vzorca h2SW3, Môže sa vypočítať, ktorá valencia alebo oxidačné číslo má síru v zlúčenine. Za týmto účelom stačí vyriešiť algebraický súčet:
2 (+1) + 1V + 3 (-2) = 0
Pretože ide o neutrálnu zlúčeninu, súčet zaťaženia atómov, ktoré ho tvoria, musí byť 0. Vymazanie V Pre predchádzajúcu rovnicu máte:
V = (6-2)/1
V sa teda rovná +4. To znamená, že síra sa podieľa na druhej Valencii a podľa tradičnej nomenklatúry sa musí prípona pridať do mena -ooso. Z tohto dôvodu, H2SW3 Je známa ako kyselina síranosiť.
Ďalším rýchlejším spôsobom, ako určiť túto Valenciu, je porovnanie H2SW3 s h2SW4.
V h2SW4 Síra má Valencia +6, takže ak jeden alebo, Valencia klesne na +4, a ak je odstránený iný, Valencia klesne na +2 (čo by bolo v prípade kyseliny škytavkaSíranosiť, H2SW2).
Aj keď menej známe, h2SW3 Môže sa tiež nazývať kyselina trioxosulfurová (IV), podľa nomenklatúry zásob.
Tvorba sírovej kyseliny v prírode
Kyselina sírová sa vytvára v prírode v dôsledku kombinácie oxidu siričitého, čo je produkt aktivity veľkých tovární, s atmosférickou vodou.
Z tohto dôvodu sa považuje za stredný produkt kyslého dažďa, ktorý spôsobuje veľké poškodenie poľnohospodárstva a životného prostredia.
Syntéza
Technicky sa tvorí síra, ktorá tvorí oxid siričitý. Potom sa rozpustí vo vode a vytvára kyselinu síru. Reakcia je však reverzibilná a kyselina sa rýchlo prelomí v reaktantoch.
Toto je vysvetlenie, prečo sa kyselina sírová nenachádza vo vodnom roztoku (ako už bolo uvedené v časti jej chemickej štruktúry).
Môže vám slúžiť: zákon o pive-lambeŽiadosti
Všeobecne platí, že použitia a aplikácie kyseliny sírovej, pretože jej prítomnosť nie je možné zistiť, odkazuje na použitie a aplikácie oxidov síry a základu a solí kyseliny.
V dreve
V procese sulfit sa vyskytuje drevená buničina vo forme takmer čistých celulózových vlákien. Na extrakciu lignínu z drevených štiepkovačov sa používa niekoľko solí kyseliny síry, pričom sa používajú vysokotlakové nádoby nazývané digestory.
Dezinfekčný prostriedok
Kyselina sírna sa používa ako dezinfekčný prostriedok.
Bielenie
Používa sa tiež ako mäkké bielenie, najmä pre materiály citlivé na chlór. Okrem toho sa používa ako zubné bielidlo a potravinová prísada.
Kozmetika
Je zložkou rôznych kozmetických látok na starostlivosť. Eliminuje škvrny spôsobené vínom alebo ovocím na rôznych látkach.
Antiseptický
Slúži ako antiseptický, je účinný na zabránenie kožným infekciám. V niektorých okamihoch sa použil pri fumigáciách na dezinfekciu lodí, vecí obetí epidémie atď.
Konzervačný agent
Kyselina síra sa používa ako konzervačný plod a zelenina a aby sa predišlo fermentácii nápojov, ako je víno a pivo.
Chemické produkty
Kyselina sírová sa používa pri syntéze liekov a chemikálií, pri vypracovaní vína a piva, pri vylepšovaní výrobkov odvodených od oleja a ako analytické činidlo.
Odkazy
- Nomenklatúra kyselín. Získané z 2.Chémia.Gatech.Edu
- Calvo Flores, F. G. Formulácia anorganickej chémie. Ugr sa obnovil.je

