Štruktúra kyseliny sulfónovej, nomenklatúra, vlastnosti, použitie
- 4842
- 518
- Tomáš Klapka
To sa nazýva kyselina sulfónová Vo všetkých zlúčeninách patriacich do rodiny organických kyselín, ktoré majú jednu alebo viac skupín3H. Niektorí autori naznačujú, že zlúčeninou otca je H-S (= O)2-Och, alebo h-tak3H, nazývaná nejaká „kyselina sulfónová“, sa však jej existencia nepreukázala ani existencia jeho tautoméru HO -S (= O) -OH známa ako „kyselina sulfur“ (H (H (H2SW3), ani v roztoku ani v tuhom stave.
Druhý je spôsobený plynným oxidom siričitým (IV) (SO2) Vo vodnom roztoku sa stáva bisulfitovými iónmi (HSO3-) a pyrosulfit (s2Ani52-) A nie na H-S (= o)2-OH alebo HO -S (= O) -OH, ktorý už preukázal mnohí chemický vedci.
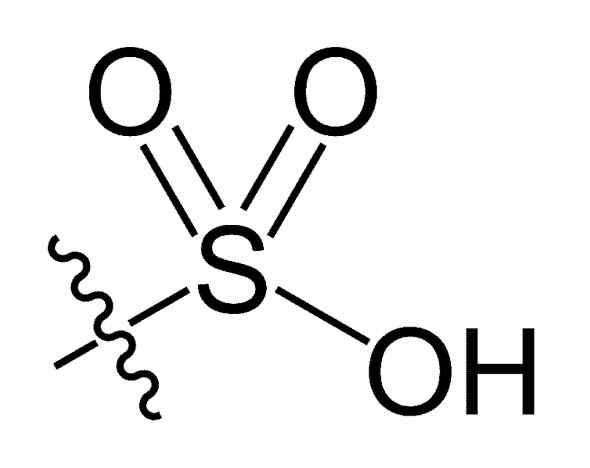
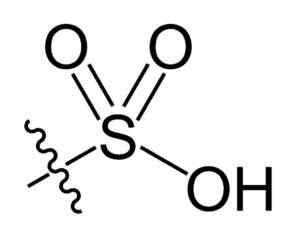 Sulfonilová skupina. Choij [verejná doména]. Zdroj: Wikipedia Commons
Sulfonilová skupina. Choij [verejná doména]. Zdroj: Wikipedia Commons V r-tak chemickom receptúre3H kyselín sulfónových, skupina R môže predstavovať uhľovodíkové kostry, ako je alkán, alqueno, alchén a/alebo piesok. Môžu obsahovať sekundárne funkcie, ako je ester, éter, ketón, amino, amido, hydroxyl, karboxylové a fenolové skupiny.
Kyseliny sulfónovej sú silné kyseliny, porovnateľné s kyselinou sírovou (H2SW4). Zvyšok jeho vlastností však do značnej miery závisí od povahy skupiny r.
Niektorí majú tendenciu desulfonaru pri vysokých teplotách. To znamená stratu skupiny -SO3H, najmä keď R je piesočnaté, to znamená s benzénovým kruhom.
Sulfónové kyseliny majú veľa použití v závislosti od ich chemického vzorca. Používajú sa na výrobu farbív, atramentov, polymérov, detergentov, povrchovo aktívnych látok a katalyzátorov, medzi mnohými ďalšími aplikáciami.
[TOC]
Štruktúra
Kyseliny sulfónovej majú nasledujúcu všeobecnú štruktúru:
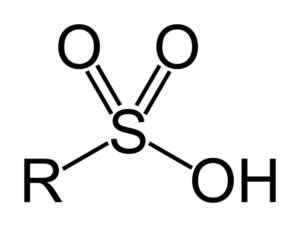 Všeobecný vzorec sulfónových kyselín. Benjah-Bmm27 [verejná doména]. Zdroj: Wikipedia Commons
Všeobecný vzorec sulfónových kyselín. Benjah-Bmm27 [verejná doména]. Zdroj: Wikipedia Commons Menovanie
- Skupina sulfonilu: -so3H
- Prenájom alebo kyselina arilsulfónová: R-SO3H
Vlastnosti
Sú pevné alebo tekuté v závislosti od skupiny r. Nie sú známe žiadne plynné kyseliny sulfónovej.
Jeho fyzikálne a chemické vlastnosti závisia od povahy skupiny r. Na porovnanie existujú niektoré fyzikálne vlastnosti niekoľkých kyselín sulfónových, kde P.F. Je to bod topenia a P.a. Je to bod varu pri tlaku 1 mm Hg:
- Kyselina metanosulfónová: P.F. 20 ° C; p.a. 122 ° C
- Kyselina etanozofónová: P.F. -17 ° C; p.a. 123 ° C
- Kyselina propulfónová: P.F. -37 ° C; p.a. 159 ° C
- Kyselina butanosulfónová: P.F. -15 ° C; p.a. 149 ° C
Môže vám slúžiť: chlorid železitý (FECL2): Štruktúra, použitie, vlastnosti- Kyselina pentosulfónová: P.F. -16 ° C; p.a. 163 ° C
- Hexanosulfónová kyselina: P.F. 16 ° C; p.a. 174 ° C
- Kyselina benzefónová: P.F. 44 ° C; p.a. 172 ° C (pri 0,1 mm Hg)
- Kyselina p-toluensulfónová: P.F. 106 ° C; p.a. 182 ° C (pri 0,1 mm Hg)
- 1-naftalensulnová kyselina: P.F. 78 ° C; p.a. Rozkladá sa
- Kyselina 2-naftalensulfónová: P.F. 91 ° C; p.a. Rozkladá sa
- Kyselina trifluórmetanosulfónová: P.F. nič; p.a. 162 ° C (pri 760 mm Hg)
Väčšina z nich je veľmi rozpustná vo vode.
Kyseliny sulfónovej sú ešte viac kyselín ako karboxylové kyseliny. Majú kyslosť podobnú ako u kyseliny sírovej. Rozpúšťajú sa vo vodnom hydroxidu sodného a vodného hydrogenuhličitanu.
Majú tendenciu trpieť tepelným rozkladom a vyskytujú sa ich desulfonáciou. Niektoré z alkosulfónových kyselín sú však tepelne stabilné. Obzvlášť kyselina trojica alebo trifluórmetánsulfónová kyselina je jednou z najsilnejších a najstabilnejších kyselín.
Získanie
Kyseliny arilsulfónovej
Kyseliny ailsulfónovej sa všeobecne získavajú prostredníctvom procesu sulfonácie, ktorý spočíva v pridaní nadbytku kyseliny sírovej dymu (H2SW4 + SW3) Do organickej zlúčeniny chceme sulfonar. Napríklad v prípade benzénu:
C6H6 + H2SW4 C6H5SW3H + h2Ani
ARH + H2SW4 Arzo3H + h2Ani
Sulfonácia je reverzibilná reakcia, pretože ak pridáme do zriedenej kyseliny benzeulfónovú kyselinu a prejdeme parou na zmesi3 A benzén je destilovaný volatilizáciou parou, čím sa rovnováha smerom k desulfonácii.
Sulfonančným činidlom môže byť tiež kyselina chlórsulfurová, kyselina sulfamová alebo sulfitový ión.
Alkylofónové kyseliny
Tieto sa všeobecne pripravujú sulfooxidáciou, tj ošetrenie alkylových zlúčenín oxidom siričitého SO2 a kyslík alebo2, alebo priamo s siričitým tričom3.
RH + 2SO2 + Ani2 + H2Alebo r-tak3H + h2SW4
Žiadosti
Kyseliny sulfónovej pre povrchovo aktívne látky a detergenty
Na výrobu detergentov sa používajú alkybenfové kyseliny, ktoré sú jedným z najrozšírenejších použití.
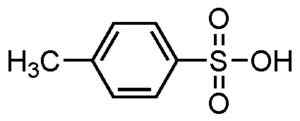 Kyselina p-metylbenzefónová. SU-NO-G. Zdroj. *Dátum = 21. augusta 2006. *Vyrobené s chemdrawom. Zdroj: Wikipedia Commons.
Kyselina p-metylbenzefónová. SU-NO-G. Zdroj. *Dátum = 21. augusta 2006. *Vyrobené s chemdrawom. Zdroj: Wikipedia Commons. Používajú sa na práškové a kvapalné čistiace prostriedky, detergenty pre ťažké alebo ľahké úlohy, ruky a šampóny mydlá.
Aktívnymi komponentmi sú všeobecne alkybenzén lineárne a sulfonované mastné estery.
Ako povrchovo aktívne látky sú bežné alfa-olefínsulfonáty, sulfobetíny, sulfosukcináty a prenajímané étere disulfonuje difenilickú, z ktorých všetky sú odvodené od sulfónových kyselín.
Môže vám slúžiť: oxalát sodný (Na2C2O4): Štruktúra, vlastnosti, použitia, rizikáTieto povrchovo aktívne látky sa nachádzajú v produktoch čistenia domácností, kozmetiky, polymerizácie v emulziách a chemickej výrobe pre poľnohospodárstvo.
Ligosulfonáty sú odvodené sulfónom z lignínu, zložky dreva a používajú sa ako disperging, zvlhčujúce, väzobné činidlá v cestných chodníkoch, betónových prísadách a prísadách v potravinách pre zvieratá.
Na zvýšenie plynulosti a pevnosti cementu sa používa kyselina 2-naftalanosulfónová kyselina.
Sfarbenie kyseliny sulfónovou
Tieto sa všeobecne charakterizujú obsahom skupín AZO (R-N = N-R).
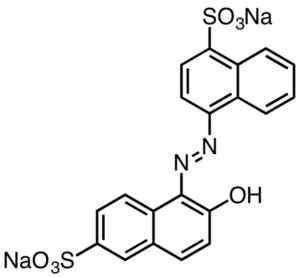 Kyslé červené sfarbenie. Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons.
Kyslé červené sfarbenie. Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons. Farby odvodené od kyseliny sulfónovej majú užitočnosť v papierovom priemysle, atramenty, ako je injekčná tlač, textil, ako je bavlna a vlna, kozmetika, mydlá, čistiace prostriedky, jedlo a koža.
Derivát kyseliny 2-naftalanosulfónovej.
Amidy založené na kyselinách sulfónovej
Táto aplikácia zdôrazňuje kyseliny akrylamidefónových, ktoré majú polyméry, v kovovej elektróde, ako sú povrchovo aktívne látky a v priehľadných protichodných povlakoch.
Používajú sa tiež na zlepšené regenerácie oleja ako látky na zlúčeniny na pôde, v hydraulických zmesiach cementu a ako aminoplastické živice vytvrdzovacie urýchľovače.
Niektoré sulfonamidy sa používajú aj vo vzorcoch insekticídov.
Fluórované a chlórfluor sulfónové kyseliny
Táto skupina zdôrazňuje kyselinu trifluórmetanosulfónovú (porovnaj3SW3H), tiež nazývaná trifická kyselina. Táto zlúčenina má katalýzu organickej syntézy a polymerizačných reakcií.
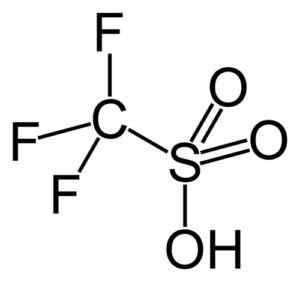 Kyselina. CAPACIO [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons.
Kyselina. CAPACIO [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons. Napríklad sa používa pri polymerizácii aromatických olefínov a pri príprave vysoko rozvetvených parafínových uhľovodíkov s vysokým oktánovým číslom na ich použitie ako prísady z paliva.
Ďalšia z jej aplikácií je v syntéze vodivých polymérov pomocou polyacetylénového dopingu, ktorý produkuje napríklad polovodiče typu typu p.
Kyselina pentafluóretanosulfónová (porovnaj3Cf2SW3H), známa ako kyselina pentapliková, sa používa ako organický katalyzátor.
Trifická kyselina reaguje s antimónovým pentafluoridom (SBF5) Generovanie So -založenej „magickej kyseliny“, super -kyslého katalyzátora, ktorý slúži na alkyláciu a polymerizáciu.
Môže vám slúžiť: jódová tinktúra: vlastnosti, použitia, kontraindikácieNafion-H je iónová výmena živici parfumovanej kyseliny sulfónovej polyméru. Má charakteristiku inertu smerom k silným kyselinám, silným základom a redukciou alebo oxidačným činidlám.
V biologických aplikáciách
Jednou z mála kyselín sulfónovej, ktorá sa nachádza v prírode.
Syntetické a prírodné býčie bojové zápasy sa používajú ako doplnky v potravinách pre domáce zvieratá a farmaceutické výrobky.
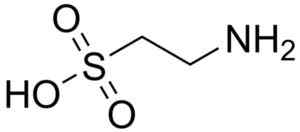 Bullfighting molekula. Prísny. Zdroj: Wikipedia Commons
Bullfighting molekula. Prísny. Zdroj: Wikipedia Commons Kyselina taurocol je zložka žlče a podieľa sa na trávení tukov. Kyselina 8-anilino-1-naftalanosulfónová, syntetická zlúčenina, sa používa pri štúdiu proteínov.
Ako inhibítory vírusu herpes simplex sa používajú kopolyméry močoviny a kyselina bifenyldisulfónová.
Niektoré deriváty kyseliny sulfónovej, ako je sulfonovaný polystyrén a niektoré azokompiestos, preukázali inhibičné vlastnosti ľudskej imunodeficiencie alebo vírusu HIV, bez toho, aby boli nadmerne toxické proti hostiteľským bunkám.
V ropnom priemysle
Určité zmesi derivátov oleja, ktoré zahŕňajú rozmanitú kombináciu aromatických, parafínov a polynukleárnych aromatických, môžu byť sulfónované a potom správne neutralizované generujúce tzv. Sulfonáty oleja.
Tieto ropné sulfonáty majú vlastnosť zníženia chirurgického napätia vo vode. Okrem toho je jej výroba veľmi nízka.
Z tohto dôvodu sa ropné sulfonáty vstrekujú do existujúcich ropných vrtov, ktoré pomáhajú zotaveniu ropy, ktoré je uzavreté medzi horninami pod povrchom.
Vo formulácii maziva a antikorotóznych
Sulfonáty horčíka sa široký využíval v mazivá.
Sulfonáty bária sa používajú v anti -flint lubrikantoch na použitie používané vo vysokorýchlostných aplikáciách. Sulfonáty sodíka a vápenatého majú mazivo a mastné tuky na zlepšenie vlastností extrémneho tlaku.
Salty horčíka kyseliny sulfónovej sú tiež užitočné v antikoróznych aplikáciách, ako sú povlaky, tuky a živice.
Odkazy
- Falk, Michael a Giguere, Paul a. (1958). O povahe kyseliny sírovej. Canadian Journal of Chemistry, zv. 36, 1958. Obnovené z nrcresearchpress.com
- Betts, r.H. a Voss, r.H. (1970). Kinetika výmeny kyslíka medzi sulfitovým iónom a vodou. Canadian Journal of Chemistry, zv. 48, 1970. Obnovené z nrcresearchpress.com
- Bavlna, f.Do. A Wilkinson, G. (1980). Pokročilá anorganická chémia. Štvrté vydanie. Kapitola 16. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 23. Štvrté vydanie. John Wiley & Sons.
- Kosswig, Kurt. (2012). Povrchovo aktívne látky. Ullmannova encyklopédia priemyselnej chémie zv. 35. Wiley-Vch Verlag GmbH & Co.
- « Štruktúra oxidu chloričitého (CLO2), použitie, získanie, riziká, vlastnosti
- Štruktúra kyseliny polyaktovej, vlastnosti, syntéza, používa »

