Štruktúra oxidu chloričitého (CLO2), použitie, získanie, riziká, vlastnosti

- 2530
- 776
- Mgr. Pravoslav Mokroš
On oxid chloričitý Je to anorganická zlúčenina tvorená prvkom chlóru (CL) a kyslíkom (O). Jeho chemický vzorec je CLO2. Je to zelenkavý až červenkastý žltý plyn. V prostredí sa prirodzene nenachádza.
Je mimoriadne reaktívny, takže je bežné, že sa pripravuje na miesto, kde sa bude používať. Jedným z najdôležitejších použití je mikrobicíd, antiseptický a dezodorizujúci, pretože eliminuje baktérie, vírusy a huby veľmi ľahko a vo veľmi nízkych koncentráciách.
 Niektoré potraviny predávané v supermarketoch mohli byť dezinfikované oxidom CLO chloričitý2. Autor: elasticComputefarm. Zdroj: Pixabay.
Niektoré potraviny predávané v supermarketoch mohli byť dezinfikované oxidom CLO chloričitý2. Autor: elasticComputefarm. Zdroj: Pixabay. Umožňuje dezinfikovať potraviny, ako je zelenina, ovocie, mäso, vtáky a morské plody. Slúži na hygienizáciu povrchov, podláh, kúpeľní, ventilačných systémov, bazénov, laboratórnych zariadení, zariadení zubného lekára atď.
Preto sa používa pri spracovaní potravín, v nemocniciach a klinikách, v priemysle a obchodoch. Používa sa na čistenie vody používanej na pitie a tiež komunálnu odpadovú vodu.
Je veľmi efektívny ako oxidačné činidlo, takže sa používa okrem iného na bielenie papierovej buničiny, oleja, múky, kože, textilných vlákien.
Ak je vo forme plynu, je veľmi nebezpečný, pretože je veľmi výbušný a používa sa hlavne vo vodných roztokoch. Je toxický, ak je vdych.
[TOC]
Štruktúra
Oxid chloričitého je tvorený spojením atómu chlóru (CL) s dvoma atómami kyslíka (O). Chlórové väzby s každým kyslíkom sú kovalentné a dvojité. Chlór v tejto zlúčenine má valenciu +4.
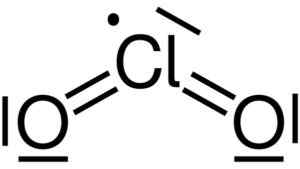 Lewisova štruktúra oxidu chloričitého2. Yikrazuul [verejná doména]. Zdroj: Wikimedia Commons.
Lewisova štruktúra oxidu chloričitého2. Yikrazuul [verejná doména]. Zdroj: Wikimedia Commons. Má symetrickú a uhol štruktúru, pretože má voľné elektróny. To znamená, že netvoria odkaz s iným atómom.
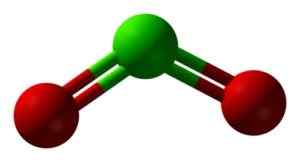 Štruktúra CLO2 v troch rozmeroch. Zelená = chlór; Červená = kyslík. Ben Mills a Jynto [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra CLO2 v troch rozmeroch. Zelená = chlór; Červená = kyslík. Ben Mills a Jynto [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
- Oxid chloričitý
- Oxid chlóru (IV)
Vlastnosti
Fyzický stav
Zelenkavo žltý až červenkastý žltý plyn.
Molekulová hmotnosť
67,45 g/mol.
Bod topenia
-59 ° C.
Bod varu
11 ° C.
Hustota
Kvapalina pri 0 ° C = 1 642 g/cm3
Plyn = 2,33 (relatívna hustota vzduchu, vzduch = 1).
Môže vám slúžiť: izoamylalkohol: štruktúra, vlastnosti, použitia a rizikáRozpustnosť
Vodné rozpustné: 2000 cm3 clo2 plyn pri 100 cm3 studenej vody alebo 0,8 g/100 ml vody pri 20 ° C. Rozpustný v alkalickom roztoku a v roztoku kyseliny sírovej H2SW4.
Chemické vlastnosti
Clo2 Je mimoriadne reaktívny a môže násilne využívať. Je to veľmi efektívne oxidačné činidlo.
Clo2 Násilne sa zlomí, ak príde do kontaktu s organickými materiálmi. Ak ste vo vzduchu pri koncentrácii vyššej ako 10%, môže explodovať kvôli slnečnému žiareniu alebo teplu.
Môžete tiež vybuchnúť v prítomnosti ortuti (HG) alebo oxidu uhoľnatého (CO).
Pri pôsobení ultrafialového (UV) alebo ozónu CLO2 Stáva sa z neho chlórový hexoxid2Ani6, veľmi nestabilná zlúčenina.
Vlastnosti vašich vodných roztokov
Jeho vodné roztoky sú žlté alebo červenkasto žlté. Sú stabilné, ak zostávajú chladné, dobre zapečatené a chránené pred slnečným žiarením. V prítomnosti svetla sa tieto roztoky pomaly rozkladajú, aby sa poskytla kyselina HCL hydrochlorovodíková a kyselina HCLO chlorovodíkovej3.
 Vodný roztok CLO2 kde sa pozoruje, že sa uvoľní žltý plyn, ktorý je CLO2. Autor: Materiál. Zdroj: Wikimedia Commons.
Vodný roztok CLO2 kde sa pozoruje, že sa uvoľní žltý plyn, ktorý je CLO2. Autor: Materiál. Zdroj: Wikimedia Commons. V alkalických roztokoch CLO2 Je rozdelený na ióny chlorita clo2- a ktorage3-. V kyslých roztokoch tvorí kyselina chlóro HCLO2 A potom sa to rozdelí na kyselinu HCl chlorovodíkovú a kyselinu chlorovodíkovú3.
Ďalšie vlastnosti
Koncentrované výpary CLO2 Sú potenciálne výbušné, takže nebolo možné komprimovať ani zmiešané iba s inými plynmi. Z tohto dôvodu sa uprednostňuje, aby ste ho pripravili na mieste, kde sa bude používať.
Ak sú to veľmi nízke teploty v hydratovanom tvare, čo je spôsob, akým sa niekedy prenáša, je to pevná látka vo forme ľadového bloku a pomaranča.
Má zápach podobnú chlóru. Je toxický inhaláciou.
Získanie
Je možné získať niekoľkými spôsobmi. Napríklad v niektorých prípadoch riešenia CLO2 Pripravujú sa na prejdenie zmesi chlórového plynu (CL2) a vzduch (alebo chlór a dusíkový plyn2) cez stĺpec, ktorý obsahuje granule chlorita sodného (NACLO2).
Môže vám slúžiť: Vrstva Valencia2 NACLO2 + Cl2 → 2 NaCl + 2 clo2
Generovaný produkt obsahuje približne 90% CLO2, Medzi ostatnými chlórovými zlúčeninami.
Získava sa tiež z chlorečnanu draselného (KCLO3) a kyselina sírová (h2SW4) V prítomnosti kyseliny oxalovej ako reduktora. V tomto prípade sa vytvorí aj oxid uhličitý (CO2), ktorá slúži na zriedenie CLO2.
Môže sa pripraviť v mieste použitia na základe chlorečana sodného (NACLO3), kyselina sírová (H2SW4) a metanol (vyberte3Oh).
V priemysle sa získa chloretom sodným (NACLO3) a oxid siričitý (SO2) V prítomnosti kyseliny sírovej.
2 NACLO3 + SW2 + H2SW4 → 2 CLO2 + 2 Nahso4
Používa sa ako dezinfekčný prostriedok
Môže sa použiť ako silné antimikrobiálne činidlo. Zistilo sa, že je vysoko účinný proti niekoľkým mikroorganizmom, ako napríklad Escherichia coli a Stafylococcus aureus.
S posledne menovaným, koncentrácia iba 5 ppm CLO2 eliminovať ich 100%. Je baktericídny, antiseptický a dezodorizujúci. Je účinný v širokom intervale pH.
Jedlo
Používa sa ako antimikrobiálne činidlo vo vode na fumimáciu ovocia a zeleniny, pri spracovaní vtákov vtákov, červeného mäsa, oboch mäsa a orgánov a morských výrobkov a morských plodov.
 Červené mäso supermarketov mohlo byť ošetrené oxidom chloričitého, aby sa dezinfikovali. Autor: Karamo. Zdroj: Pixabay.
Červené mäso supermarketov mohlo byť ošetrené oxidom chloričitého, aby sa dezinfikovali. Autor: Karamo. Zdroj: Pixabay. Roztoky oxidu chloričitého by sa mali používať v koncentrácii, ktorá nepresahuje 3 ppm (strany na milión) CLO2 zvyšok, takže nemá vplyv na jedlo.
Po liečbe CLO2 Všetky potraviny musia byť úplne ovládané pitnou vodou alebo by sa mali používať ako obara, varenie alebo konzervované.
V prípade morských výrobkov je kanalizačný roztok2 Mal by sa používať vo vode a ľade, ktoré sa používajú pri oplachovaní, umývaní, rozmrazovaní, preprave alebo skladovaní. Surové morské plody sa potom musia pred spotrebou veľmi dobre umyť pitnou vodou.
 Studená voda a ľad, s ktorým ovocie morské ovocie obsahujú malé množstvá CLO2. Autor: verejné domény. Zdroj: Pixabay.
Studená voda a ľad, s ktorým ovocie morské ovocie obsahujú malé množstvá CLO2. Autor: verejné domény. Zdroj: Pixabay. Na papieri a lepenke, ktoré prídu do styku s jedlom
Riešenia CLO2 Používajú sa na odstránenie mikroorganizmov, ktoré spôsobujú štíhle (ako sú riasy, baktérie a huby) v procesnej vode používanej pri výrobe papiera a lepenky, ktoré prídu do styku s potravinami.
Môže vám slúžiť: apolárne molekulyV pitnej vode
Slúži na čistenie vody a na to, aby bola pitná (bezpečná na pitie). Používa sa pri predbežnom ošetrení vody, ktorá bude potom fľaštovaná na pitie alebo vodu, ktorá sa použije ako prísada pri výrobe nápojov alebo nealkoholických nápojov.
 Niektoré spracované nealkoholické nápoje môžu obsahovať upravenú vodu s CLO2. Susan Slater [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Niektoré spracované nealkoholické nápoje môžu obsahovať upravenú vodu s CLO2. Susan Slater [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. V zubnom lekárstve
Používa sa v nástrojoch používaných zubárom alebo zubárom na ich dezinfekciu a zničenie patogénových organizmov v nich.
V lekárskych aplikáciách
Vodné roztoky CLO2 Boli použité na liečbu ústnej kandidózy (infekcia úst). Candidiasis je infekcia húb Candida albicans.
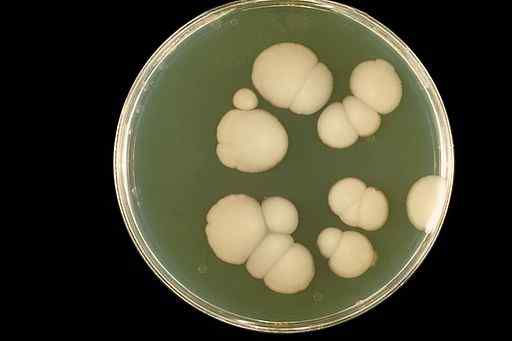 Vzhľad huby Candida albicans v laboratórnej plodine. CDC/DR. William Kaplan [verejná doména]. Zdroj: Wikimedia Commons.
Vzhľad huby Candida albicans v laboratórnej plodine. CDC/DR. William Kaplan [verejná doména]. Zdroj: Wikimedia Commons. Oxid chloričitého eliminuje ústa z úst a významne zlepšuje vzhľad orálnych tkanív bez vedľajších účinkov.
Niektorí lekárski vedci naznačujú, že riešenia CLO2 Aplikované na rany chirurgických operácií môžu znížiť alebo potlačiť tvorbu prístupov bez toho, aby ovplyvnili ich vyliečenie, s ďalšou výhodou jeho antiseptických vlastností.
Iné použitia
Pre jeho oxidačné a mikrobicídne vlastnosti CLO2 sa používa pre:
- Bieli celulózu dreva pri výrobe buničiny a papiera, čo poskytuje stabilný lesk.
- Ozdobte tuky a oleje, kožu, bielú múku a textil.
- Poľnohospodárske aplikácie, ako je dezinfekcia tvrdých povrchov, vybavenia, vodných systémov a húbových skleníkov.
- Aplikácie v odvetviach, obchodoch a nemocniciach, ako je dezinfekcia tvrdých povrchov (steny, podlahy, kúpeľne), ventilačné systémy, laboratórne vybavenie.
- Dezinfikovať byty a kúpeľne domácností, klimatizačných systémov, systémy obehu plaveckej vody.
- Zaobchádzanie s obecnou a priemyselnou odpadovou vodou.
- Čistenie znečistenia ropných polí.
- Výroba chloridových soli (CL-).
Riziká
- Koncentrované výpary CLO2 Sú potenciálne výbušné.
- Je toxický inhaláciou a požitím. Je to dráždivé oko, nos a hrdlo, môže spôsobiť pľúcny edém a chronickú bronchitídu.
- Podľa zdrojov konzultoval CLO2 nespôsobuje mutácie DNA alebo spôsobuje rakovinu u ľudí.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Oxid chloričitý. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Dean, J.Do. (editor). (1973). Lange's Handbook of Chemistry (jedenáste vydanie). McGraw-Hill Book Company.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. VCH Verlagsgellschaft MBH.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Bajpai, P. (2012). Bielenie oxidu chloričitého. Účinok bielenia oxidu chloričitého na kvalitu buničiny. V environmentálne benígnych prístupoch k bieleniu buničiny (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Moran, s. (2018). Chémia vody. Oxid chloričitý. V aplikovanom sprievodcovi po návrhu závodu na čistenie vody a odpadových vôd. Zotavené z vedeckých pracovníkov.com.
- McKen, L. (2012). Úvod do potravín a lekárska sterilizácia. Utier. V účinku sterilizácie na plasty a elastoméry (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- « Horné paleolitické charakteristiky, umenie, sociálna organizácia
- Štruktúra kyseliny sulfónovej, nomenklatúra, vlastnosti, použitie »

