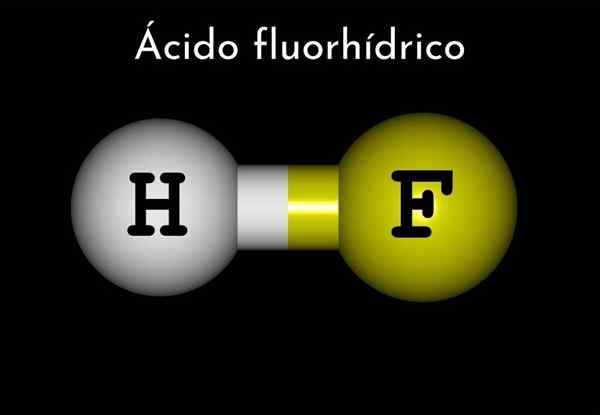
Kyselina fluórska (HF)
- 1263
- 50
- Mgr. Pravoslav Mokroš
Čo je kyselina fluórska?
On kyselina (HF)Je to vodný roztok, v ktorom sa rozpustí fluorid vodíka. Táto kyselina sa získava hlavne z reakcie kyseliny sírovej koncentrovanej fluoritovým minerálom (CAF2). Minerál je degradovaný pôsobením zostávajúcej kyseliny a voda rozpúšťa plyny fluoridu vodíka.
Z tej istej kyslej vody sa môže čistý produkt destilovať, to znamená fluorid vodíka anhydridu. V závislosti od množstva rozpusteného plynu sa získavajú rôzne koncentrácie, a preto na trhu niekoľko dostupných produktov kyseliny fluórhy.
Pri koncentrácii menej ako 40 %má nerozoznateľný kryštalický vzhľad vody, ale pri vyšších koncentráciách sa rozlúči s výparmi fluoridu bieleho vodíka. Kyselina fluórska je známa ako jedna z najagresívnejších a najnebezpečnejších chemikálií.
Je schopný „jesť“ takmer akýkoľvek materiál, s ktorým máte kontakt: od skla, keramiky a kovov, po skaly a betón. V ktorej sa potom kontajner uloží? V plastových fľašiach, inertné syntetické polyméry do vašej činnosti.
Vzorec
Vzorec fluoridu vodíka je HF, ale z kyseliny fluórhy je reprezentovaný vo vodnom médiu HF (AC), aby sa odlíšilo od prvého.
Kyselina fluórska sa teda môže považovať za hydrátový fluorid vodíka, a to je anhydrid.
Štruktúra kyselina
 3D model kyseliny fluorhydrovej
3D model kyseliny fluorhydrovej Všetka kyselina vo vode má schopnosť vytvárať ióny v rovnovážnej reakcii. V prípade kyseliny fluoridov sa odhaduje, že v roztoku je dvojica honov h3Ani+ a f-.
Anión f- Pravdepodobne tvoria veľmi silný vodíkový most s jedným z katiónových vodíkov (F-H-O+-H2). To vysvetľuje, prečo je kyselina fluorhorhoorová slabá kyselina (darca protónov, h+), napriek svojej vysokej a nebezpečnej reaktivite; to znamená, že vo vode neuvoľňuje toľko h+ V porovnaní s inými kyselinami (HCL, HBR alebo HI).
Môže vám slúžiť: Koľko elektrónov s pudingom má uhlík?Avšak v koncentrovaných interakciách kyseliny fluórhy medzi molekulami fluoridu vodíka sú dostatočne účinné na to, aby im umožnili uniknúť v plynnej fáze.
To znamená, že vo vode môžu interagovať, akoby boli v kvapalnom anhydride, čím sa medzi nimi tvoria vodíkové mosty. Tieto vodíkové mosty môžu byť asimilované ako takmer lineárne reťazce (H-F-H-F-H-F-…) obklopené vodou.

Na vynikajúcom obraze sa nezdieľaný krútiaci moment elektrónov orientovaný v opačnom smere odkazu (H-F :) interaguje s ďalšou molekulou HF na zostavenie reťazca.
Vlastnosti kyselina
Pretože je to kyselina fluórická, vodný roztok, jej vlastnosti závisia od koncentrácie anhydridu rozpustenej vo vode. HF je veľmi rozpustný vo vode a je hygroskopický, je schopný produkovať rôzne roztoky: od veľmi koncentrovaných (fajčenia a žltých tónov) po veľmi zriedené.
Keď sa jej koncentrácia znižuje, HF (AC) prijíma vlastnosti viac podobné čistej vode ako anhydrid. H-F-H vodíkové mosty sú však silnejšie ako vo vode, h2Oh.
Obaja koexistujú v harmónii v roztokoch a zvyšujú body varu (do 105 ° C). Podobne sa zvyšuje hustoty, keď sa rozpustí viac hinhydridu. Zvyšok má všetky roztoky HF (AC) silné a dráždivé pachy a sú bezfarebné.
Reaktivita
Aké je korozívne správanie kyseliny fluórhy? Odpoveď je v spojení H-F a schopnosti atómu fluóru formovať veľmi stabilné kovalentné väzby.
Pretože fluorid je veľmi malý a elektronegatívny atóm, je to mocná kyselina Lewis. To znamená, že sa oddeľuje od vodíka k prepojeniu druhov, ktoré ponúkajú viac elektrónov s nízkymi nákladmi na energiu. Napríklad tieto druhy môžu byť kovy, napríklad kremík prítomný v skle.
Môže vám slúžiť: jadrová chémia: História, štúdium, oblasti, aplikácieSIO2 + 4 HF → SIF4g) + 2 h2Ani
SIO2 + 6 HF → H2SIF6 + 2 h2Ani
Ak je disociačná energia spojenia H-F vysoká (574 kJ/mol), prečo je zlomená v reakciách? Odpoveď má kinetické, štrukturálne a energetické nuansy. Všeobecne platí, že čím menej reaktívny je výsledný produkt, tým viac uprednostňuje jeho formovanie.
Čo sa stane s f- vo vode? V koncentrovaných roztokoch fluórickej kyseliny Ďalšia molekula HF môže tvoriť vodíkový mostík s F- páru [h3Ani+F-].
To vedie k vytvoreniu defluoridového iónu [FHF]-, čo je mimoriadne kyslé. Preto je všetok fyzický kontakt s tým mimoriadne škodlivý. Najmenšia expozícia môže spôsobiť nekonečno poškodenia agentúry.
Existuje veľa bezpečnostných štandardov a protokolov pre primerané riadenie, a preto sa vyhnite potenciálnym nehodám pre tých, ktorí pracujú s touto kyselinou.
Použitie/aplikácie kyseliny fluórhy
Je to zlúčenina s mnohými aplikáciami v priemysle, vo výskume a práci spotrebiteľov:
- Kyselina fluórska vytvára organické deriváty zapojené do procesu čistenia hliníka.
- Používa sa na oddelenie izotopov uránu, ako v prípade uránu hexafluoruro (UF6). Používa sa tiež na extrakciu, spracovanie a rafináciu kovov, hornín a olejov, ktoré sa tiež používajú na inhibíciu rastu plesní a odstraňovania plesní.
- Na vyrezávanie a zaznamenávanie kryštálov, najmä mrazivých, pomocou techniky leptania sa používajú vlastnosti korozívnych kyselín.
- Používa sa na výrobu silikónových polovodičov, s viacnásobným využitím pri vývoji výpočtovej techniky a počítačovej vedy, zodpovednej za ľudský rozvoj.
- Používa sa v automobilovom priemysle ako čistič, ktorý sa používa ako odstraňovač plesní v keramike.
- Okrem toho, že slúži ako sprostredkovateľ v niektorých chemických reakciách, sa používa kyselina fluórska v niektorých iónových výmenníkoch zapojených do čistenia komplexnejších kovov a látok.
- Zúčastnite sa na spracovaní ropy a jeho derivátov, čo umožnilo získanie rozpúšťadiel na použitie pri výrobe výrobkov na čistenie a elimináciu tukov.
- Používa sa na generovanie činidiel na dyha a povrchové ošetrenie.
- Spotrebitelia používajú početné výrobky, na ktorých sa na jej vypracovaní zúčastnila kyselina fluórska; Napríklad niektoré potrebné pre starostlivosť o auto, čistenie výrobkov pre nábytok, elektrické a elektronické komponenty a palivá, okrem iných výrobkov.
Odkazy
- Publikácia. (2018). Kyselina. Získané 3. apríla 2018, od: Pubchem.Ncbi.NLM.NIH.Vláda.
- Deň. (16. apríla 2013). Kyselina, ktorá skutočne jedí všetko. Získané 3. apríla 2018, od: ChronicleFlask.com
- Wikipedia. (28. marca 2018). Kyselina. Získané 3. apríla 2018, od: In.Wikipedia.orgán.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie., p. 129, 207-249, 349, 407). MC Graw Hill.
- Kyselina. Mušt. Lekárska univerzita v Južnej Karolíne. Získané 3. apríla 2018, od: AcademicDepartments.Mušt.Edu