Čo je disulfurické, čo je, štruktúra, vlastnosti, používa
- 1390
- 38
- MUDr. Miloslav Habšuda
Čo je kyselina disulfurová?
On kyselina disulfurová Je to jeden z mnohých síry oxoacid, ktorých chemický vzorec je H2Siež2Ani7. Vzorec výslovne naznačuje, že existujú dva atómy síry, a ako tiež poukazuje na jeho názov, musia existovať dve H molekuly H2SW4 len jeden; Existuje však sedem kyslíka namiesto ôsmich, takže síra musí mať tri.
Táto kyselina je jednou z hlavných zložiek oleja (alebo kyseliny sírovej dymu), ktorá sa stáva „hustým“ tvarom kyseliny sírovej. Taká je ich prevaha, ktorá niektorí považujú za synonymum pre kyselinu disulfurovú; čo je známe aj podľa tradičného názvu kyseliny pyrosulfurovej.
Na obrázku je zobrazený príjemca s olejom, s koncentráciou trioxidu siričitého, takže3, 20 %. Táto látka sa vyznačuje tým, že je mastná a bezfarebná; Aj keď žltkastý alebo hnedý môže byť žltý v závislosti od koncentrácie SO3 a prítomnosť niektorých nečistôt.
Vyššie uvedené popisuje účasť SO3 v h2Siež2Ani7; to znamená molekula H2SW4 Reagovať s jedným zo SO3 Na vytvorenie kyseliny disulfurovej. Byť vtedy, h2Siež2Ani7 Môže byť tiež napísaný ako h2SW4· SW3.
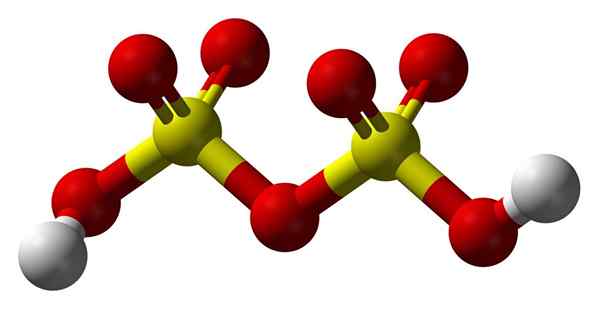
Štruktúra kyseliny disulfurovej
 Štruktúra kyseliny disulfurovej
Štruktúra kyseliny disulfurovej Nahor2Siež2Ani7 V modeli guľôčok a tyčí. Všimnite si symetriu molekuly: ľavá strana kyslíkového mostíka je identická so pravou. Z tohto hľadiska je možné štruktúru opísať pomocou vzorec Ho3Nevýrazný3H.
Na obidvoch koncoch je každá hydroxylová skupina, ktorej vodík, indukčným účinkom všetkých týchto atómov kyslíka, zvyšuje svoju pozitívnu čiastočnú zaťaženie; A preto má kyselina disulfurová ešte silnejšia kyselina ako kyselina sírová.
Môže vám slúžiť: hydroxid draselný: štruktúra, vlastnosti, použitiaMolekula môže byť napísaná ako h2SW4· SW3. Vzťahuje sa to však viac na zloženie oleu ako na štruktúru molekuly.
Ak sa však k h pridá molekula vody2Siež2Ani7, Uvoľnia sa dve molekuly H2SW4:
H2Siež2Ani7 + H2Alebo 2h2SW4
Rovnováha sa môže presunúť doľava: k vytvoreniu H2Siež2Ani7 Z h2SW4 Ak sa dodáva teplo. Z tohto dôvodu je h2Siež2Ani7 Je tiež známa ako kyselina pyrosulfurová; Pretože sa môže generovať po zahrievaní kyseliny sírovej.
Ako už bolo spomenuté na začiatku, h2Siež2Ani7 Je tvorená priamou kombináciou H2SW4 A tak3:
SW3 + H2SW4 H2Siež2Ani7
Vlastnosti
 Oleum. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], cez Wikimedia Commons
Oleum. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], cez Wikimedia Commons Vlastnosti kyseliny disulfurovej nie sú príliš dobre definované, pretože je mimoriadne ťažké ich izolovať výlučne z oleja.
Malo by sa pamätať na to, že v oleji môžu byť ďalšie zlúčeniny, s h h2SW4· Xso3, kde v závislosti od hodnoty x môže mať dokonca polymérne štruktúry.
Jedným zo spôsobov, ako vizualizovať, je predstaviť si, že horná štruktúra H2Siež2Ani7 stáva sa viac predĺženými jednotkami tak3 a kyslíkové mosty.
V takmer čistom stave pozostáva z nestabilnej kryštalickej tuhej látky (fajčenie), ktorá sa topí pri 36 ° C. Tento bod topenia sa však môže líšiť v závislosti od skutočného zloženia.
Kyselina disulfurová môže tvoriť to, čo sa nazýva solí disulfáty (alebo pyrosulfát). Napríklad, ak reagujete s hydroxidom draselným, vytvorte pyrosulfát draselného, K2Siež2Ani7.
Okrem toho je možné poznamenať, že má molekulovú hmotnosť 178 g/mol a dva kyslé ekvivalenty (2 hodiny ióny+ ktoré sa dajú neutralizovať silnou základňou).
Môže vám slúžiť: volatilizáciaReakcia na dehydratáciu cukru
S touto zlúčeninou v tvare oleja je možné vykonať zvláštnu reakciu: transformácia hrudiek uhlíkových blokov.
H2Siež2Ani7 Reaguje s cukrami, ktoré eliminujú všetky svoje OH skupiny vo forme vody, čo uprednostňuje nové odbory medzi atómami uhlíka; odbory, ktoré nakoniec spôsobujú čierne uhlie.
Menovanie
Kyselina disulfurová sa považuje za anhydrid kyseliny sírovej; To znamená, že stráca molekulu vody kondenzácie medzi dvoma kyslými molekulami. Pred toľkými možnými názvami pre túto zlúčeninu, nomenklatúra IUPAC jednoducho odporúča, aby bola kyselina disulfurová.
Termín „Piro“ sa naráža výlučne na to, čo sa tvorí ako produkt aplikácie tepla. IUPAC toto meno neodporúča pre h2Siež2Ani7; Ale v súčasnosti ho v súčasnosti používa mnoho chemikov.
Ukončenie -ICO zostáva nemenné, pretože atóm síry naďalej udržiava valenciu +6. Napríklad sa dá vypočítať nasledujúcou aritmetickou operáciou:
2h + 2s + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Žiadosti
Ukladá kyselinu sírovú
Kyselina disulfurová, vzhľadom na svoju vlastnosť na stuhnutie ako olej, je schopná rozpustiť a ukladať bezpečnejšie kyselinu sírovú. Je to preto, že SO3 Úniky vytvárajú nezákonne „hmlu“, ktorý je v H oveľa rozpustnejší2SW4 ako vo vode. Na získanie h2SW4, Stačilo by sa pridať do vodného oleja:
H2Siež2Ani7 + H2Alebo 2h2SW4
100% syntéza kyseliny sírovej
Z predchádzajúcej rovnice, h2SW4 Je zriedený v pridanej vode. Napríklad, ak máte vodný roztok h2SW4, Kde to tak3 Má tendenciu uniknúť a predstavuje riziko pre pracovníkov, pričom k roztoku pridáva olej, ktorá reaguje s vodou tvoriacou viac kyseliny sírovej; to znamená zvýšenie jej koncentrácie.
Môže vám slúžiť: chemická nepreniknuteľnosťAk zostane nejaká voda, pridá sa to viac3, ktorý reaguje s H2SW4 na výrobu viac kyseliny disulfurovej alebo oleja a potom opäť hydratuje „sušenie“ H2SW4. Proces opakuje niekedy dosť na to, aby sa získala kyselina sírová pri 100% koncentrácii.
Podobný proces sa používa na získanie 100% kyseliny dusičnej. Podobne sa používa na dehydratáciu iných chemických látok, ktoré sa používajú na výbušné vypracovanie.
Sulfonácia
Štruktúry, ako sú farbivá; to znamená, pridajte skupiny -So3H, ktorý stratí váš kyslý protón, ktorý môže byť ukotvený v polyméri textilného vlákna.
Na druhej strane sa kyslosť oleu používa na dosiahnutie druhej dusičnanu (pridať skupiny -NO2) do aromatických krúžkov.
Odkazy
- Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Kyselina pyrosulfurová. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- « 20 vynálezov renesancie, ktorá zmenila svet
- Bakteriálne náter, čo je, charakteristiky a príprava »

