Bakteriálne náter, čo je, charakteristiky a príprava
- 2146
- 126
- Tomáš Klapka
On Bakteriálny náter Je to predĺženie vo forme tenkého filmu suspenzie bakteriálnych mikroorganizmov, ktoré sa vyrábajú na priehľadnej sklenenej doske alebo sklíčku na pozorovanie pod optickým mikroskopom.
Rozšírenie vo forme filmu sa vykonáva s cieľom čo najviac oddeliť mikroorganizmy, pretože ak je pozorovanie zoskupené, nie je jasné.
Pri štúdiu bakteriálnych plodín sa na ich lepšiu analýzu používajú techniky bakteriálnych plodín, techniky prípravy náterov, fixácie a sfarbenia. Z dôvodu malej veľkosti mikroorganizmov sa nevyhnutne vyžaduje použitie optického mikroskopu na pozorovanie.
Optické mikroskopy sú nevyhnutné nástroje na pozorovanie náter. Tieto používajú optické šošovky a svetlo, ktoré umožňujú vizualizáciu vzoriek s veľkým zväčšením veľkosti.
Všeobecne platí, že živé bunky nemajú zásadne zafarbené štruktúry, pohľady na optický mikroskop sú bezfarebné, priehľadné vzorky a vykazujú veľmi malý vnútorný kontrast as svojím okolím.
Pozorovanie jednoduchým optickým mikroskopom čistého poľa bez použitia techník pomocného farbenia je veľmi obmedzené a používa sa iba v niektorých prípadoch, ako pri pozorovaní hnutia mikroorganizmu.
Na optimálne pozorovanie mikroorganizmov je potrebné dosiahnuť rovnováhu medzi kontrastom a rozlíšením. Podrobnosti buniek nemožno pozorovať pri mikroskope, a to aj s vysokým rozlíšením; Vyžaduje sa použitie farbív prostredníctvom farbiacich techník, ktoré prispievajú k kontrastu pozorovania.
Charakteristiky kvalitnej bakteriálnej náter
Vynikajúci kontrast
Na dosiahnutie vynikajúci kontrast existujú sofistikované mikroskopy nazývané Fázový kontrastný mikroskop, diferenciálna interferencia a mikroskop tmavého poľa. Tento typ mikroskopu sa používa na pozorovanie bakteriálnych štruktúr, ako sú napríklad struky a vlákna.
Farbenie je jednoduchá technika na zvýšenie kontrastu, ktorý sa dosiahne pomocou mikroskopu s priehľadným poľom. V tejto technike sa môžu použiť rôzne farbivá, ktoré významne zlepšujú pozorovanie mikroskopu.
Farbenie sa vyrába priamo na náteroch alebo predĺženiach mikroorganizmov suspenzie na sklíčkach, predtým sušených a fixovaných.
Dobrý
Fixovanie je technika, ktorá sa používa na zachovanie bunkových štruktúr; spôsobuje inaktiváciu mikroorganizmov a adhézie na pohárik posúvača. Existujú rôzne úpravy fixácie: fixácia tepla a chemická fixácia.
Môže vám slúžiť: kyselina palmtoleová: štruktúra, funkcie, kde jeTepelná fixácia
Toto je najpoužívanejšia metóda pri pozorovaní bakteriálneho náter. Táto technika spočíva v odovzdávaní bakteriálnej suspenzie náterov plameňom zapaľovača. Táto technika je schopná zachovať vonkajšiu morfológiu baktérií, ale zničí jej vnútorné štruktúry.
Chemická fixácia
Chemická fixácia používa okrem iného chemické látky, ako je formaldehyd alebo formalín, etanol a kyselina octová. Výhodou použitia fixácie chemických látok je to, že sa dosiahne zachovanie vnútorných bunkových štruktúr mikroorganizmov.
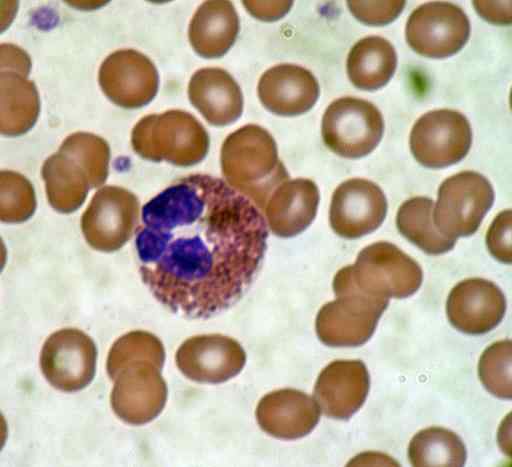
 Krv. Zdroj: bobjgalindo [gfdl (http: // www.GNU.Org/copyleft/fdl.HTML) alebo CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons
Krv. Zdroj: bobjgalindo [gfdl (http: // www.GNU.Org/copyleft/fdl.HTML) alebo CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons Dobré farbenie
Najbežnejšie postupy pri vykonávaní zafarbenia predtým sušenia a fixného náter sú pozitívne alebo jednoduché farbenie, diferenciálne zafarbenie a negatívne zafarbenie. Existujú tiež špeciálne techniky na zafarbenie konkrétnych bunkových štruktúr (kapsula, spóry, bičíky).
Pozitívne farbenie alebo jednoduché zafarbenie
Pozitívne alebo jednoduché zafarbenie je najpoužívanejšou technikou farbenia náter. Používajte farbivá, ktoré majú schopnosť pripojiť sa.
Tieto farbivá majú v chemickej štruktúre chromofórové skupiny (farebná časť), s alternatívnymi dvojitými väzbami a jednoduchými väzbami (konjugácia). Tieto odkazy môžu zase vytvoriť iónové alebo kovalentné väzby s niektorými bunkovými štruktúrami.
Farbivá používané v pozitívnom alebo jednoduchom farbení sú väčšinou chemické deriváty anilín (farebné organické soli).
Na druhej strane, medzi farbami nájdeme niektoré so základným pH a iné s kyslým pH.
Základné farbivá
V základných farbách má skupina chromofor kladné elektrické náboj. Prevažná väčšina prokaryotických mikroorganizmov má vnútorné neutrálne pH a ich bunkový povrch má negatívne zaťaženie. Prostredníctvom tejto elektrostatickej interakcie je chromofor viazaný na bunku a farbivo.
Príkladmi základných farbív sú okrem iného metylénová modrá, fialové sklo, malachitovo zelená, základná poistka, safranín,.
Kyslé farbivá
V kyslých farbách má skupina chromofor negatívny elektrický náboj. Používajú sa na zafarbenie proteínov s pozitívnymi skupinami náboja. Príkladmi kyslých farbív sú kyslá poistka, bengálska ruža, kongo červená a eozín.
Môže vám slúžiť: Propage: Čo je, typy a ich vlastnostiDiferenciálne zafarbenie
Technika diferenciálneho farbenia je aplikovať dva farbivá rôznych farieb alebo intenzity, na rozlíšenie mikroskopu mikroskopu. Farbenie gramov a farbenie odolnosti voči alkoholu kyselinou sú najpoužívanejším diferenciálnym farbením v bakteriológii.
Gramovo farbenie sa používa ako predbežný test na poznanie tvaru, veľkosti, bunkovej skupiny, okrem typu bunkovej steny. Podľa testu farbenia gramu sa baktérie bunkovej steny klasifikujú ako gram pozitívne baktérie a gramne negatívne baktérie.
Negatívne zafarbenie
V tejto technike sa používajú chemické farbivá, ktoré neprenikajú do bunkového interiéru, ale vytvárajú médium, v ktorom sa mikroorganizmy javia ako čierne pozadie.
V technike negatívnej farbenia sa náter pripravuje s kvapkou čínskeho alebo nigrosínového atramentu, ktorý po povolení sušenia pri izbovej teplote tvorí nepriehľadný film na priechod svetla. Týmto spôsobom sa mikroorganizmy pozorujú ako jasné formy na tmavom pozadí.
Príprava
Do. Rozmazať
1.- Veľmi dobre umyte sklíčka, suchý s absorpčným papierom a označte ich. Štítok musí uviesť obsah prípravy, dátumu a názvu tých, ktorí ho spracovali.
2.- Zapaľujte zapaľovač a sterilizuje rukoväť naočkovania v plameňoch na červenú nažive.
3.- Nechajte rukoväť.
4.- Vezmite bakteriálnu trubicu, odstráňte uzáver a rýchlo prejdite ústami trubice blízko ľahšieho plameňa (plameň).
5.- Vstúpte do rukoväte očkovania do trubice, ktorá obsahuje bakteriálnu kultúru a odoberte vzorku.
6.- Ak je plodina v tekutine, vložte vzorku odobratú rukoväťou do stredu posúvača a opatrne ju natiahnite do kruhu s priemerom približne 2 cm.
7.- Sterilizovať rukoväť naočkovania.
8.- Nechajte sušenie náteru vo vzduchu.
9.- Opakujte kroky od 3 do 8 trikrát.
10.- Ak je plodina v tuhej látke, musí sa predtým umiestniť kvapka destilovanej vody. Toto sa robí na zmiešanie malej vzorky plodiny odobratej s rukoväťou naočkovania podľa indikácií krokov 2 až 5 (podmienky asepsy).
Môže vám slúžiť: vývojová biológia: história, aké štúdie, aplikáciejedenásť.- Rozšírte vzorku zriedenú kvapkou vody na posúvaní a opakujte trikrát.
B. Upevnenie
1.- Pridajte do suchého rozmazu -učitelia plodín v kvapalinových médiách -kvapky metanolu alebo absolútneho etanolu.
2.- Nechajte vysušenie vzduchu od zapaľovania.
3.- Ak náter pochádza z tuhej kultúry, pevne sa vyrába suchý zápach z tepla a prechádza ho 2 až 3 -krát rýchle.
4.- Dotknite sa spodnej časti náteru s dorzálnou časťou ľavej ruky (pre pravé ruky; inak používajte pravú ruku) a overte, či je studený.
C. Jednoduché zafarbenie
1.- Pridajte k náter 2 kvapky vybraného farbiva a nechajte sa konať pre čas potrebný v konkrétnych protokoloch každého farbiva (zvyčajne medzi 1 a 5 minútami).
2.- Niektoré farbivá vyžadujú na aktiváciu využívanie tepla, v takom prípade musíte byť veľmi opatrní pri zahrievaní batožiny v plameňoch zapaľovača (manipulujte s pinzetou a vyhýbajúc sa varu). Prehrievanie náteru môže zničiť požadované bunky.
3.- Odstráňte prebytočné farbivo pre umývanie destilovanou vodou z obrázka. Eliminujte umývaciu vodu a jemne zasiahne snímku pre svoju pieseň, naklonená na pracovný stôl.
4.- Povoliť sušenie vzduchu.
5.- V závislosti od typu pozorovania sa v tejto fáze používa kryt alebo nie. Kryt a zachováva náter. Ak sa v tejto fáze vykonáva pozorovanie potápania oleja, náter sa nepoužíva, ale náter sa nedá zachovať.
D. Definitívne zachovanie náteru
1.- V každom z roztokov uvedených nižšie, minimálne 5 minút. Účelom týchto „kúpeľní“ je nechať náter úplne dehydratovaný. Každé činidlo musí byť dobre vypustené, pred vstupom do náteru v nasledujúcej kúpeľni.
Poradie dehydratačných kúpeľov je nasledujúce:
- 70 % etanol
- 95 % etanol
- Čistý acetón
- Acetónová zmes -xilol 1: 1
- Xilol
Potom povolte sušenie vzduchu.
2.- Pripevnite kryty, najlepšie 22 × 22 mm, pomocou balzamu Kanady alebo iných prostriedkov na montáž.
Odkazy
- Cappucino, J.G. a Welch, C.Tón. (2017). Mikrobiológia: manuálne laboratórium. Pearson.
- Holt, J.G. Editor. (1977). Kratšia Bergeyova príručka determinatívnej bakteriológie. 8th Baltimore: Williams a Wilkins Co.

