Štruktúra kyseliny chromovej, vlastnosti, získanie, použitie, použitia

- 1570
- 97
- Alan Milota
On kyselina alebo h2Croch4 Kyselina spojená s oxidom chrómu (VI) alebo oxidom CRO CROMIC je teoreticky3. Táto nominálna hodnota je spôsobená skutočnosťou, že v kyslých vodných roztokoch chrómového oxidu druhu h2Croch4 Je prítomný s inými druhmi chrómu (VI).
Oxid3 Nazýva sa tiež kyselina bezvodá chromová. Cro3 Je to červenkastá alebo fialová hnedá tuhá látka, ktorá sa získa pri ošetrení roztokov dichromátu draselného k2Cr2Ani7 S kyselinou sírovou H2SW4.
 Rozdrvenie oxidu cromického3 V topiacich sa hrnci. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons.
Rozdrvenie oxidu cromického3 V topiacich sa hrnci. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons. Roztoky vodného chromického oxidu zažívajú rovnováhu určitých chemických druhov, ktorých koncentrácia závisí od pH roztoku. Základné pH prevláda ióny cromátu cro42-, Zatiaľ čo ióny kyseliny HCRO prevládajú4- a Cr DiCromato2Ani72-. Odhaduje sa, že kyselina kyselina kyselina je tiež prítomná kyselina chromová h2Croch4.
Vďaka svojej veľkej oxidačnej sile sa roztoky kyseliny chromovej používajú v organickej chémii na vykonávanie oxidačných reakcií. Používajú sa tiež v elektrochemických procesoch na ošetrenie kovov, aby získali odolnosť voči korózii a opotrebeniu.
Niektoré polymérne materiály sa tiež ošetrí kyselinou chromovou, aby sa zlepšila ich adhézia na kovy, maľby a iné látky.
Roztoky kyseliny chromovej sú veľmi nebezpečné pre ľudí aj pre väčšinu zvierat a životné prostredie. Z tohto dôvodu sa kvapalné alebo tuhé procesy odpadu, kde sa používa kyselina chromová.
[TOC]
Štruktúra
Molekula kyseliny chromovej H2Croch4 Je tvorený crómovým iónom42- a dva vodíkové ióny h+ Zjednotiť sa. V chromátovom ióne je chrómový prvok v oxidačnom stave +6.
Priestorová štruktúra chromátového iónu je tetraedrálna, kde je chróm v strede a kyslík zaberá štyri vrcholy tetraedronu.
V atómoch vodíka kyseliny chrómovej sú každé vedľa kyslíka. Zo štyroch chrómových väzieb s atómami kyslíka sú dva dvojité a dva sú jednoduché, pretože majú hydrogény spojené s nimi.
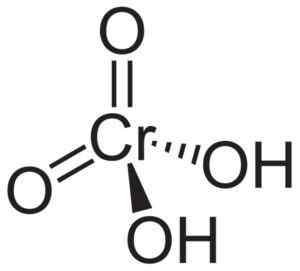 Štruktúra kyseliny chromovej H2Croch4 kde sa pozoruje tetraedrálna forma chromátu a jeho dvojité väzby. Neuroteker [verejná doména]. Zdroj: Wikipedia Commons.
Štruktúra kyseliny chromovej H2Croch4 kde sa pozoruje tetraedrálna forma chromátu a jeho dvojité väzby. Neuroteker [verejná doména]. Zdroj: Wikipedia Commons. Na druhej strane, oxid cro -croomic3 Má oxidačný chrómový atóm +6 obklopený iba tromi atómami kyslíka.
Menovanie
- Kyselina cromová H2Croch4
- Kyselina tetraoxochromová H2Croch4
- CROMIC oxid (kyselina bezdôvodná chromová) CRO3
- Trioxid chrómu (kyselina bezdôvodná chromová) CRO3
Vlastnosti
Fyzický stav
Kyselina anhydro alebo chróm oxidu chromová je kryštalická tuhá látka fialovej až červenej
Molekulová hmotnosť
Croch3: 118,01 g/mol
Bod topenia
Croch3: 196 ° C
Nad jeho teplotou topenia je tepelne nestabilný, stráca kyslík (je znížený), čím sa poskytne oxid chróm (III) Cr2Ani3. Rozkladá sa približne pri 250 ° C.
Hustota
Croch3: 1,67-2,82 g/cm3
Rozpustnosť
Cro3 Je veľmi rozpustný vo vode: 169 g/100 g vody pri 25 ° C.
Je rozpustný v minerálnych kyselinách, ako je sírová a dusičnená. Rozpustný alkohol.
Ďalšie vlastnosti
Cro3 Je veľmi hygroskopický, jeho kryštály sú chutné.
Keď cro3 Rozpúšťa sa vo vode, ktoré tvorí silne kyslé roztoky.
Môže vám slúžiť: titán: História, štruktúra, vlastnosti, reakcie, použitieJe to veľmi silný oxidant. Oxy rázne organická hmota takmer vo všetkých jej formách. Útočí na látku, kožu a niektoré plasty. Väčšina kovov tiež zaútočí.
Je silne jedovatý a veľmi dráždivý kvôli svojmu vysokému oxidačnému potenciálu.
Chémia vodných roztokov, kde je prítomná kyselina chromová
Oxid3 Rýchlo sa rozpúšťa vo vode. Vo vodnom roztoku môže existovať chróm (VI) v rôznych iónových formách.
PH> 6,5 alebo v alkalickom roztoku Chrome (VI) získava formu Cromato iónov42- žltá.
Ak sa pH zníži (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , ktoré môžu dimerizovať na ión dikromato cr2Ani72-, A riešenie sa stáva oranžovým. Pri pH medzi 2,5 a 5,5 prevládajúcimi druhmi sú HCRO4- a cr2Ani72-.
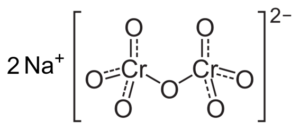 Štruktúra iónovej dikromátu Cr2Ani72- ktorý je vedľa dvoch sodíkových iónov+. CAPACIO [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons.
Štruktúra iónovej dikromátu Cr2Ani72- ktorý je vedľa dvoch sodíkových iónov+. CAPACIO [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons. Zostatky, ktoré sa vyskytujú v týchto riešeniach, keď pH klesá, sú nasledujúce:
Croch42- (chrómový ión) + h+ ⇔ HCRO4-
HCRO4- + H+ ⇔ h2Croch4 (Kyselina chromová)
2HCRO4- ⇔ cr2Ani72- (Dikromát ión) + h2Ani
Tieto zostatky sa vyskytujú iba vtedy, ak je kyselina pridaná na zníženie pH3 alebo HCLO4, Pretože s inými kyselinami sa tvoria rôzne zlúčeniny.
Kyslé roztoky dichromátu sú veľmi energetické oxidačné činidlá. Ale v alkalických roztokoch je chromátový ión oveľa menej oxidačný.
Získanie
Podľa konzultovaných zdrojov je jedným zo spôsobov, ako získať oxid CRO Cromic3, To spočíva v pridaní kyseliny sírovej do vodného roztoku dichromátu sodíka alebo draselného, čím sa vytvorí červenooranžová zrazenina.
 Cromický oxid hydratovaný alebo kyselina chromová. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons.
Cromický oxid hydratovaný alebo kyselina chromová. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons. Kyselina cromová H2Croch4 Nachádza sa vo vodných roztokoch chromického oxidu v kyslom médiu.
Kyselina chromová používa
Pri oxidácii chemických zlúčenín
Kvôli svojej silne oxidačnej kapacite sa kyselina chromová používa už dlho a úspešne na oxidovanie organických a anorganických zlúčenín.
Spomedzi nespočetných príkladov patrí nasledujúce: umožňuje oxidáciu primárnych alkoholov aldehydosom a tieto k karboxylové kyseliny, alkoholy sekundárne k ketónom, toluén k kyseline benzoovej, etylbenzén na acetofenón, trifenylmetano na trifenylcarbinol, kyselina formová A kyselina A Co -Co -Co -Co2, kyselina oxalová pre CO2, kyselina mliečna na acetaldehyd a co2, Železná viera2+ Viera v Faith Ferric3+, Ion jodid na jód, atď.
Umožňuje konverziu dusných komplexných na nitro-komplikácie, sulfidy na sulfóny. Zasahuje do syntézy ketónov založených na alkénoch, pretože oxidovali hydroborované alkény na ketóny.
Zlúčeniny veľmi odolné voči obvyklým oxidantom, ako je kyslík alebo2 alebo peroxid vodíka h2Ani2, Sú oxidované kyselinou chromovou. Toto je prípad určitých heterocyklických bastessov.
V procesoch kovového anodizácie
Anodizácia kyseliny chromovej je elektrochemické ošetrenie, ktoré sa vzťahuje na hliník na jeho ochranu po mnoho rokov pred oxidáciou, koróziou a opotrebením.
Proces anodizácie zahŕňa elektrochemickú tvorbu vrstvy oxidu hlinitého alebo hlinitého na kovu. Táto vrstva je potom utesnená horúcou vodou, ktorá sa dosiahne konverziou na trihydratovaný oxid hlinitý.
Vrstva utesneného oxidu je hrubá, ale je štrukturálne slabá a nie príliš uspokojivá pre následné adhézne odbory. Avšak pridaním malého množstva kyseliny chromovej do tesniacej vody sa vyvinie povrch, ktorý môže tvoriť dobré väzby.
Môže vám slúžiť: Zákon o zachovaní hmotyKyselina chromová v tesniacom vode rozpúšťa časť buniek hrubého typu a zanecháva tenkú, silnú, pevne pripojenú k oxidu hlinitého, na ktoré sa lepidlá prilepia a tvoria silné a trvalé kĺby.
Anodizácia s kyselinou chromovou sa vzťahuje aj na titán a jeho zliatiny.
Pri ošetrení chemickej premeny
Kyselina chromová sa používa v procesoch poťahovania kovu chemickou premenou.
Počas tohto procesu sú kovy ponorené do roztokov kyseliny chromovej. To reaguje a čiastočne rozpustí povrchové ukladanie súčasne tenká vrstva komplexných zlúčenín chrómu, ktoré interagujú so základným kovom.
Tento proces sa nazýva konverzný náter chromatov alebo konverzný chróm.
Kovy, ktoré sú všeobecne vystavené konverznému chrómu, sú rôzne typy ocele, ako je uhlíková oceľ, nehrdzavejúca oceľ a oceľ potiahnutá zinkom a niekoľko neoterných kovov, ako sú zliatiny horčíka, zliatiny hliníka, zliatiny hliníka, meď, kadmium, mangán a striebro.
Toto ošetrenie poskytuje odolnosť proti korózii a jasu voči kovu. Vyššie pH procesu Väčšia rezistencia voči korózii. Teplota zrýchľuje kyslú reakciu.
Môže sa aplikovať povlak rôznych farieb, napríklad modrá, čierna, zlatá, žltá a priehľadná. Poskytuje tiež lepšie dodržiavanie kovového povrchu smerom k obrazom a lepidlom.
V erodovanom alebo nasekanom povrchu
Roztoky kyseliny chromovej sa používajú pri príprave povrchu termoplastického materiálu, termosebilných polymérov a elastomérov na neskoršie povlaky s maľbami alebo lepidlami.
H2Croch4 dosahuje vplyv na povrchovú chémiu a jej štruktúru, pretože pomáha zvyšovať jej drsnosť. Kombinácia uhryznutia a oxidácie zvyšuje penetráciu lepidiel a môže dokonca spôsobiť zmeny vo vlastnostiach polyméru.
Používa sa na erodovanie rozvetveného polyetylénu s nízkou hustotou, s vysokou hustotou a polypropylénovým lineárnym polyetylénom.
Používa sa veľa v elektro-receiptskom priemysle alebo galvanoplastike na uľahčenie adhézie kov-polyméru.
Na niekoľkých použitiach
Kyselina chromová sa používa ako drevená konzervačná látka, tiež v magnetických materiáloch a na chemické reakcie katalýza.
Kyselina cromová
Existuje mnoho procesov, ktoré používajú kyselinu chromovú a vytvárajú prúdy alebo zvyšky, ktoré obsahujú chróm (III), ktoré nemožno zlikvidovať, pretože majú chrómové ióny (VI), ktoré sú veľmi toxické alebo opätovne použitie, pretože koncentrácia chromátových iónov je veľmi nízka.
Jeho dispozícia vyžaduje chemické zníženie chromátov na chróm (III), po ktorom nasleduje zrážanie hydroxidu a filtrácie, čo generuje ďalšie náklady.
Z tohto dôvodu sa študovali rôzne metódy na odstránenie a obnovenie chromátov. Tu sú niektoré z nich.
Prostredníctvom používania živíc
Po mnoho rokov sa používajú iónové výmenné živice na úpravu vody kontaminovanej chromatovou vodou. Toto je jedna z ošetrení schválených agentúrou na ochranu životného prostredia USA alebo EPA (skratka pre angličtinu agentúra na ochranu životného prostredia).
Táto metóda umožňuje regeneráciu koncentrovanej kyseliny chromovej, pretože sa znova regeneruje zo živicovej.
Živice môžu byť silné alebo slabé základne. V silne základných živícoch môže byť chromát odstránený ako HCRO ióny4- a cr2Ani72- Vymieňajú sa s OH iónmi- a cl-. V slabo základných živici, napríklad sulfátu, sa ióny vymieňajú so SOS42-.
Môže vám slúžiť: NepeometriaV prípade silne základných živíc R- (OH) sú globálne reakcie nasledujúce:
2ROH + HCRO4- + H+ ⇔ r2Croch4 + 2h2Ani
R2Croch4 + 2HCRO4- ⇔ 2RHCRO4 + Croch42-
R2Croch4 + HCRO4- + H+ ⇔ r2Cr2Ani7 + H2Ani
Pre každý mol r2Croch4 Prevedenie jedného molu Cr (vi) roztoku je odstránené, vďaka čomu je táto metóda veľmi atraktívnou.
Po odstránení chromátov sa živica ošetrí silne alkalickým roztokom, aby sa ich regenerovalo na bezpečnom mieste. Potom sa chromáty prevedú na koncentrovanú kyselinu chromovú, ktorá sa má znovu použiť.
Prostredníctvom elektrochemickej regenerácie
Ďalšou metódou je elektrochemická regenerácia kyseliny chromovej, ktorá je tiež veľmi pohodlnou alternatívou. Prostredníctvom tohto postupu je chróm (III) oxidovo oxidovaný na chróm (VI). Anódový materiál v týchto prípadoch je výhodne oxid oxid.
Použitie mikroorganizmov na čistenie odpadových vôd s pozostatkami kyseliny chromovej
Metóda, ktorá bola skúmaná a stále sa skúma, je použitie mikroorganizmov prítomných prirodzene v určitých odpadoch kontaminovaných hexavalentnými chrómovými iónmi, ktoré sú obsahom v roztokoch kyseliny chromovej.
 Škodlivé odpadové odpady pre životné prostredie. Autor: OpenClipart-vektory. Zdroj: Pixabay.
Škodlivé odpadové odpady pre životné prostredie. Autor: OpenClipart-vektory. Zdroj: Pixabay. Taký je prípad určitých baktérií prítomných vo vodách so opaľovaním odpadových vôd. Tieto mikróby boli študované a určené, že sú rezistentné na chromáty a sú tiež schopné redukovať chróm (VI) na chróm (iii), ktorý je oveľa menej škodlivý pre životné prostredie a živé bytosti.
Z tohto dôvodu sa odhaduje, že sa môžu použiť ako metóda priaznivej pre prostredie na nápravu a detoxikáciu odpadových vôd kontaminovaných pozostatkami kyseliny chromovej.
Kyselina chromová a chrómový oxid
Cro3 Nie je to palivo, ale môže zintenzívniť spaľovanie iných látok. Mnohé z vašich reakcií môžu spôsobiť oheň alebo výbuch.
Cro3 a roztoky kyseliny chromovej sú silnou dráždivou pokožkou (môžu spôsobiť dermatitídu), oči (môžu ich spáliť) a sliznice (môžu spôsobiť bronchasmu) a môžu spôsobiť takzvané „chrómové dutiny“ v respiračnom systéme.
Chrómové zlúčeniny (VI), ako je kyselina chromová a chrómový oxid, sú pre väčšinu živých bytostí vážne toxické, mutagénne a karcinogénne.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Alebo.Siež. Lekárska knižnica. (2019). Kyselina. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wegman, r.F. a Van Twisk, J. (2013). Zliatiny hliníka a hliníka. 2.5. Proces eloxizácie kyseliny chromovej. V technikách prípravy povrchu na lepenie lepidla (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Wegman, r.F. a Van Twisk, J. (2013). Horčík. 6.4. Príprava zliatiny horčíka a horčíka procesmi ošetrenia kyseliny chromovej. V technikách prípravy povrchu na lepenie lepidla (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Grot, w. (2011). Žiadosti. 5.1.8. Regenerácia kyseliny chromovej. Vo fluórovaných ionoméroch (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Swift, K.G. a Booker, J.D. (2013). Proces povrchového inžinierstva. 9.7. Chrómovanie. Vo výbere výrobného procesu príručka. Zotavené z vedeckých pracovníkov.com.
- Poulson, a.H.C. a kol. (2019). Techniky modifikácie povrchu PEEK, vrátane povrchového spracovania plazmy. jedenásť.3.2.1. Leptanie povrchu. V príručke PEEK Biomaterials Handbook (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Westheimer, f.H. (1949). Mechanizmy oxidácií kyseliny chromovej. Chemical Reviews 1949, 45, 3, 419-451. Získané z krčiem.ACS.orgán.
- Opálenie, h.Klimatizovať.Siež. (1999). Obnova kyseliny chromovej podľa výmeny aniónov. The Canadian Journal of Chemical Engineering, Zväzok 77, február 1999. Zdroj: z online knižnice.Mravný.com.
- Kabir, m.M. a kol. (2018). Izolácia a charakter baktérií znižujúcich chróm (VI) z koželubných odpadov a pevných odpadov. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI sa zotavila.NLM.NIH.Vláda.
- « Charakteristiky priemyselnej krajiny, prvky a príklady
- Molekulárna štruktúra kyselina cyanhydrová, vlastnosti, používa »

