Molekulárna štruktúra kyselina cyanhydrová, vlastnosti, používa

- 1801
- 359
- Václav Višňovský
On kyselina o Kyanid vodíka je organická zlúčenina, ktorej chemický vzorec je HCN. Je tiež známy ako metanonitril.
Kyselina cyanhydrová je bezfarebný, extrémne jedovatý plyn, ktorý sa získa pri ošetrení kyanidov kyselinami. Táto kyselina sa nachádza vo vnútri semena hrášku, známa tiež na mnohých miestach ako broskyňa.
 Semeno broskyne, ktoré obsahuje kyanid vodíka alebo kyanid vodíka, HCN. A.Ha [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons.
Semeno broskyne, ktoré obsahuje kyanid vodíka alebo kyanid vodíka, HCN. A.Ha [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons. Pri okolitej teplote menšej ako 25 ° C je kvapalina a nad touto teplotou je plyn. V obidvoch prípadoch je pre človeka mimoriadne toxický, zvieratá a dokonca aj väčšina mikroorganizmov, ktoré na ňu aklimatizovali. Je to dobré rozpúšťadlo pre ióny. Je veľmi nestabilný, pretože má tendenciu ľahko polymerizovať.
Nachádza sa v rastlinnom kráľovstve začlenenom do molekúl niektorých glukozidov, pretože keď sú hydrolyzované enzýmami zeleniny, HCN, glukóza a benzaldehyd sa získajú.
Tieto glukozidy sú vo vnútri semien určitých ovocia, ako sú broskyne, marhule, čerešne, slivky a horké mandle, takže by sa nikdy nemali požívať.
Nachádza sa tiež v rastlinách, ako sú niektoré druhy ciroku. Okrem toho ju niektoré baktérie produkujú počas svojho metabolizmu. Väčšinou sa používa pri výrobe polymérov a v niektorých metalurgických procesoch.
HCN je smrtiaci jed v dôsledku inhalácie, požitia a kontaktu. Je prítomný v dyme cigarety a v dyme ohňa plastov a materiálov, ktoré obsahujú uhlík a dusík. Považuje sa za znečisťujúcu ovzdušia, ktorá sa vyskytuje počas spaľovania organického materiálu z rozsiahlych oblastí planéty.
[TOC]
Molekulárna štruktúra a elektronická konfigurácia
Kyanid vodíka alebo kyanidová kyselina je kovalentná, molekulárna zlúčenina s atómom vodíka, uhlíkom a jedným z dusíka.
Atóm uhlíka a dusíka zdieľajú 3 páry elektrónov, takže tvoria trojitý odkaz. Vodík je spojený s uhlíkom, ktorý s touto úniou predstavuje svoj Valencia de Cuatro a jeho úplný oktet elektrónov.
Dusík predstavuje päť Valencia po piatich a na dokončenie oktetu má pár zmiznutých alebo osamelých elektrónov umiestnených laterálne.
HCN je preto úplne lineárna molekula, s niekoľkými chýbajúcimi elektrónmi umiestnenými bočne v dusíku.
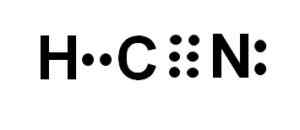 Lewisová reprezentácia kyseliny cyanhydrovej, kde sa pozorujú elektróny zdieľané v každej väzbe a pár osamelých dusíkových elektrónov. Autor: Marilú Stea.
Lewisová reprezentácia kyseliny cyanhydrovej, kde sa pozorujú elektróny zdieľané v každej väzbe a pár osamelých dusíkových elektrónov. Autor: Marilú Stea. 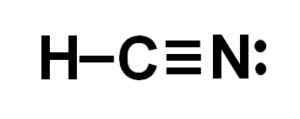 Kyanid vodíka alebo kyanidová štruktúra vodíka, kde sa pozoruje trojitá väzba medzi uhlíkom a dusíkom. Autor: Marilú Stea.
Kyanid vodíka alebo kyanidová štruktúra vodíka, kde sa pozoruje trojitá väzba medzi uhlíkom a dusíkom. Autor: Marilú Stea. Menovanie
- Kyselina
- Kyanid vodíka
- Metanonitril
- Formonitril
- Kyselina
Vlastnosti
Fyzický stav
Pod 25,6 ° C, ak je bezvodý a stabilizovaný, je to veľmi nestabilná a toxická svetlo modrá kvapalina alebo modrá. Ak je nad touto teplotou, je mimoriadne jedovatý bezfarebný plyn.
Molekulová hmotnosť
27,03 g/mol
Bod topenia
-13,28 ° C
Bod varu
25,63 ° C (všimnite si, že vrie tesne nad okolitú teplotu).
Bod vzplanutia
-18 ° C (metóda zatvoreného pohára)
Samostatná teplota
538 ° C
Môže vám slúžiť: plynová chromatografiaHustota
0,6875 g/cm3 pri 20 ° C
Rozpustnosť
Úplne miešateľné s vodou, etylalkoholom a etyléterom.
Disociačná konštanta
K = 2,1 x 10-9
Pkdo = 9,2 (je to veľmi slabá kyselina)
Niektoré chemické vlastnosti
HCN má veľmi vysokú dielektrickú konštantu (107 až 25 ° C). Je to preto, že ich molekuly sú veľmi polárne a sú spojené vodíkovými mostmi, ako v prípade vody h2Ani.
Za takú vysokú dielektrickú konštantu sa HCN ukázalo byť dobrým ionizujúcim rozpúšťadlom.
Kvapalný bezvodý HCN je veľmi nestabilný, má tendenciu násilne polymerizovať. Aby sa tomu zabránilo, pridávajú sa stabilizátory, ako malé percento H2SW4.
Vo vodnom roztoku a v prítomnosti amoniaku a amenínu s vysokým tlakom, zlúčenina, ktorá je súčasťou DNA a RNA, to znamená biologicky dôležitá molekula.
Je to veľmi slabá kyselina, pretože jej ionizačná konštanta je veľmi malá, takže je iba čiastočne vo vode a dáva kyanidovému aniniu CN-. Tvoriť soli so základňami, ale nie s uhličitanou.
Jeho vodné roztoky, ktoré nie sú chránené pred svetlom4.
V roztoku predstavuje slabú vôňu mandlí.
Kričanie
Pretože je to slabá kyselina, vo všeobecnosti nie je korozívna.
Avšak vodné roztoky HCN obsahujúce kyselinu sírovú ako stabilizátor silne útočia oceľ pri teplotách vyšších ako 40 ° C a nehrdzavejúcej ocele pri teplotách vyšších ako 80 ° C.
Okrem toho môže HCN zriedené vodné roztoky spôsobiť uhlíkovú oceľ aj pri izbovej teplote.
Môžete tiež zaútočiť na niektoré druhy gumy, plastov a povlakov.
Miesto v prírode
Je pomerne hojný v rastlinnom kráľovstve, ktoré je súčasťou glukozidov.
Napríklad je generovaný z tonzilínu C6H5-CH (-CN) -o-glycose-glykóza, zlúčenina prítomná v horkých mandľoch. Tonsil je kyanogénny beta-glukozid, pretože pri hydrolyzizácii tvorí dve molekuly glukózy, jeden z benzaldehydu a jeden z HCN. Enzým, ktorý ich uvoľňuje, je beta-glukoxidáza.
Tonsil sa nachádza v semenách broskýň, marhule, horkých mandlí, čerešní a sliviek.
Niektoré typy rastlín ciroku obsahujú kyanogénny glucóside nazývaný Durrina (to znamená P-hydroxy- (Siež)-Mandelonitrila-beta-d-glukozid). Táto zlúčenina sa dá degradovať dvoma -rýchlostnou enzymatickou hydrolýzou.
Po prvé, enzým Durrinosa, ktorý je endogénny v rastlinách ciroku hydrolys s glukózou a p-hydroxy- (Siež) -Mandelonitrila. Potom sa tento rýchlo stane voľným HCN a p-hydroxibenzaldehyd.
 Závod ciroku s vysokým obsahom Durriny. Nie je k dispozícii žiadny strojovo čitateľný autor. Pethan predpokladal (na základe nárokov na autorské práva). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikipedia Commons.
Závod ciroku s vysokým obsahom Durriny. Nie je k dispozícii žiadny strojovo čitateľný autor. Pethan predpokladal (na základe nárokov na autorské práva). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikipedia Commons. HCN je zodpovedný za odolnosť rastlín ciroku voči škodcom a patogénom.
To je vysvetlené skutočnosťou, že Durrina a enzým Durrinosa majú v týchto rastlinách rôzne miesta a vstupujú do kontaktu iba vtedy, keď sú tkanivá zranené alebo zničené, uvoľňujú HCN a chránia rastlinu infekcií, ktoré by mohli preniknúť cez poškodenú stranu.
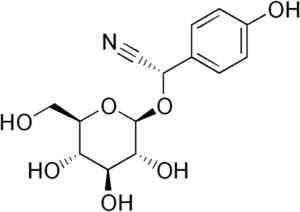 Molekula Durrina, kde je pozorovaná trojitá väzba CN, že enzymatickou hydrolýzou produkuje HCN. EDGAR181 [verejná doména]. Zdroj: Wikipedia Commons.
Molekula Durrina, kde je pozorovaná trojitá väzba CN, že enzymatickou hydrolýzou produkuje HCN. EDGAR181 [verejná doména]. Zdroj: Wikipedia Commons. Navyše niektoré patogénne baktérie ľudskej bytosti, ako napríklad Pseudomonas aeruginosa a P. Gingivalis Vytvárajú to počas svojej metabolickej aktivity.
Žiadosti
Pri príprave iných chemických a polymérových zlúčenín
Použitie zahŕňajúce väčšinu HCN vyrobenej na priemyselnej úrovni je príprava sprostredkovateľov na organickú syntézu.
Môže vám slúžiť: oxid železa (ii): Štruktúra, nomenklatúra, vlastnosti, použitiaPoužíva sa v adiponitrilovej syntéze NC- (ch2)4-CN, ktorý sa používa na prípravu nylonu alebo nylonu, polyamid. Slúži tiež na prípravu Acrilonitrila alebo Cianoethylén Cho2= CH-CN, používaný na prípravu akrylových a plastových vlákien.
Jeho derivátový kyanid sodný sa používa na zotavenie zlata pri ťažbe tohto kovu.
Ďalší z jeho derivátov chlorid cyanogénu CLCN slúži pre receptúry pesticídov.
HCN sa používa na prípravu chelatačných činidiel, ako je EDTA (etylen-diamino-tetra-acetato).
Slúži na výrobu ferrocyanidov a niektorých farmaceutických výrobkov.
Rôzne použitia
Plyn HCN sa používa ako insekticíd, fungicíd a dezinfekčný prostriedok na fumigáciu lodí a budov. Tiež fumigovať nábytok, aby ste ich obnovili.
HCN sa používa v kovovom leštení.
Pre svoju veľmi vysokú toxicitu bol vymenovaný za chemického vojnového agenta.
V poľnohospodárstve
Používa sa ako herbicíd a pesticíd v sadoch. Použil na kontrolu šupín a iných patogénov citrusových stromov, ale niektorí z týchto škodcov sa stali odolnými voči HCN.
Používa sa tiež na fumimáciu obilných síl. Plynný HCN pripravený na mieste sa použil pri fumigácii pšeničných zŕn na ich zachovanie pred škodcami, ako sú hmyz, huby a hlodavce. Na toto použitie je nevyhnutné, aby sa semená fumigovali s personálom pesticídov.
Testy fumigujúce semená pšenice sa vykonali s HCN a zistilo sa, že ich klíčivý potenciál nemá negatívne, ale zdá sa, že to uprednostňuje.
Vysoké dávky HCN však môžu výrazne znížiť dĺžku malých listov, ktoré vyrastajú zo semena.
Na druhej strane, vzhľadom na skutočnosť, že ide o mocný nematid a že niektoré rastliny ciroku ho majú vo svojich tkanivách, sa skúma potenciál rastlín ciroku na použitie ako biocídne zelené hnojivo.
Jeho použitie by slúžilo na zlepšenie pôdy, potláčanie burín a kontrolné choroby a poškodenie spôsobené fytoparazitickými nematódami.
Riziká
Pre ľudskú bytosť je HCN smrtiacim jedom na všetkých trasách: vdýchnutie, požitie a kontakt.
 Autor: Clker-Free-Vector-Images. Zdroj: Pixabay.
Autor: Clker-Free-Vector-Images. Zdroj: Pixabay. Vdýchnutie môže byť smrteľné. Odhaduje sa, že asi 60-70% populácie môže zistiť vôňu horkých mandlí HCN, keď je vo vzduchu pri koncentrácii 1-5 ppm.
Existuje však 20% populácie, ktorá ju stále nedokáže zistiť pri letálnych koncentráciách, aby to bolo geneticky schopné tak urobiť.
Požitý je akútny a okamžitý akčný jed.
Ak vaše roztoky prídu do kontaktu s pokožkou, pridružený kyanid môže byť smrteľný.
HCN je prítomný v cigaretovom dyme a ten, ktorý sa generuje, keď sa spália plasty, ktoré obsahujú dusík.
Mechanizmus smrtiaceho pôsobenia v rámci organizmu
Je to chemická látka a je rýchlo toxická, často vedie k smrti. Po vstupe do organizmu sa spája metaloenzýmy (enzýmy, ktoré obsahujú kovový ión), inaktivujúce ich. Je to toxické činidlo pre niekoľko orgánov ľudského tela
Jeho hlavný toxický účinok spočíva v inhibícii bunkového dýchania, pretože deaktivuje enzým, ktorý ovplyvňuje fosforyláciu v mitochondriách, ktoré sú organely, ktoré okrem iného zasahujú do respiračnej funkcie buniek.
Môže vám slúžiť: draslík permanganát (KMNO4)Riziko cigaretového dymu
HCN je prítomný v cigaretovom dyme.
Aj keď veľa ľudí pozná účinok otravy HCN, len málo ľudí si uvedomuje, že sú vystavení svojmu škodlivému účinku cigaretovým dymom.
HCN je jednou z príčin inhibície niekoľkých bunkových respiračných enzýmov. Množstvo HCN prítomné v cigaretovom dyme má škodlivý vplyv na nervový systém.
Hladiny HCN boli hlásené v cigaretovom dyme medzi 10 a 400 μg na cigaretu pre dym priamo a 0,006 až 0,27 μg/cigareta na sekundárne vdychovanie (pasívny fajčiar). HCN vyvoláva toxické účinky od 40 μm ďalej.
 Autor: Fotografie Alexas. Zdroj: Pixabay.
Autor: Fotografie Alexas. Zdroj: Pixabay. Rýchlo vdýchnutie vstúpi do krvného obehu, kde sa uvoľňuje v plazme alebo sa viaže na hemoglobín. Malá časť sa premieňa na tiociato a vylučuje sa močom.
Riziko zahrievania HCN
Predĺžené vystavenie tepla tekutiny HCN v uzavretých nádobách môže spôsobiť násilné a neočakávané prasknutie z nich. Môže výbušne polymerizovať 50-60 ° C v prítomnosti alkalických stopy a v neprítomnosti inhibítorov.
Prítomnosť HCN v ohňovzdornom dyme
HCN sa uvoľňuje počas spaľovania polymérov, ktoré obsahujú okrem iného dusík, ako je vlna, hodváb, polyakrylonitrilos a nylon. Tieto materiály sú prítomné v našich domovoch a vo väčšine miest ľudskej činnosti.
Z tohto dôvodu počas požiarov môže byť HCN potenciálne príčinou úmrtia inhaláciou.
Znečisťujúce látky
HCN je znečisťujúca látka troposféry. Je odolný voči fotólysi a za podmienok prostredia atmosféry netrpí hydrolýzu.
OH hydroxylové radikály • Produkované fotochemicky môžu reagovať s HCN, ale reakcia je veľmi pomalá, takže polovičný život HCN v atmosfére je 2 roky.
Keď sa Biomass Burns, najmä dav, HCN sa uvoľní do atmosféry a tiež počas priemyselných aktivít. Spaľovanie rašeliny je však 5 až 10 -krát viac znečisťujúce ako spaľovanie iného typu biomasy.
Niektorí vedci zistili, že vysoké teploty a sucho spôsobené javom El Niño v určitých oblastiach planéty Exacerb.
 Autor: Steve Buissinne. Zdroj: Pixabay.
Autor: Steve Buissinne. Zdroj: Pixabay. To vedie k intenzívnemu popáleniu biomasy v suchých staniciach.
Tieto udalosti sú zdrojom vysokých koncentrácií HCN v troposfére, ktoré sa nakoniec prepravujú do nízkej stratosféry, zostávajúce veľmi dlho.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Alebo.Siež. Lekárska knižnica. (2019). Kyanid vodíka. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Gidlow, D. (2017). Aktualizácia vodíka kyanidu-. Pracovná medicína 2017; 67: 662-663. NCBI sa zotavila.NLM.NIH.Vláda.
- Vedecká encyklopédia Van Nostrand. (2005). Kyanid vodíka. 9th Zdroj: z online knižnice.Mravný.com.
- Ren, a.-L. a kol. (Devätnásť deväťdesiat šiestich). Vplyv kyanidu vodíka a karbonylsulfidu na klíčenie a plume vigor pšenice. Pestrý. Sci. 1996, 47, 1-5. Zdroj: z online knižnice.Mravný.com.
- Z Nicoly, G.R. a kol. (2011). K jednoduchej analytickej metóde vyhodnotenia obsahu dhurrínu v kyanogénnych rastlinách na ich použitie v krmive a biofumigácii. J. Poľnohospodárstvo. Potravinárska chémia. 2011, 59, 8065-8069. Získané z krčiem.ACS.orgán.
- Ona, p.A. a kol. (2017). Globálne vylepšenie kyanidu vodíka v dolnej stratosfére Throuppout 2016. Geofy. Hovädzie mäso. Launt., 44, 5791-5797. Zotavené z agupubov.Online knižnica.Mravný.com.
- Surleva, a.R. a drochioiu, g. (2013). Vizualizačné fajčenie: Jednoduché spektrofotometrické stanovenie kyanidu vodíka v cigaretovom dyme a filtroch. J. Chem. Pedagóg. 2013, 90, 1654-1657. Získané z krčiem.ACS.orgán.
- Alarie a. a kol. (1990). Úloha kyanidu vodíka pri ľudských úmrtiach pri ohni. V ohni a polyméri. Kapitola 3. Séria sympózia ACS. Získané z krčiem.ACS.orgán.
- « Štruktúra kyseliny chromovej, vlastnosti, získanie, použitie, použitia
- 8 experimentov s veľmi kontroverznými ľuďmi »

