Štruktúra cyklohexen, vlastnosti, syntéza a použitie

- 2446
- 540
- Alan Milota
On Cyklohexen Je to alkén alebo cyklický olefín, ktorého molekulárny vzorec je C6H10. Skladá sa z bezfarebnej tekutiny, nerozpustnej vo vode a miešateľne s mnohými organickými rozpúšťadlami. Vyznačuje sa horľavou av prírode sa zvyčajne vyskytuje v hulle decht.
Cyklohexen sa syntetizuje čiastočnou hydrogenáciou benzénu a dehydratáciou cyklohexanolového alkoholu; to znamená viac oxidovaný spôsob. Rovnako ako iné cykloalquény, prežíva elektrofilné pridávanie a voľné radikály; Napríklad halogenačná reakcia.
 Molekula cyklohexen. Zdroj: Neurotoger.
Molekula cyklohexen. Zdroj: Neurotoger. Tento cyklický (horný obraz) tvorí aceotropné zmesi (nie je možné separovať destiláciou), s nižšími alkoholmi a kyselinou octovou. Nie je príliš stabilný v predĺženom skladovaní, pretože sa rozkladá pod pôsobením slnečného žiarenia a ultrafialového žiarenia.
Cyklohexen sa používa ako rozpúšťadlo, a preto má početné aplikácie, ako napríklad: vysoký oktánový stabilizátor benzínu a extrakcia oleja.
Ale najdôležitejšou vecou je, že cyklohexen slúži ako sprostredkovateľ a surovina na získanie početných zlúčenín s veľkou užitočnosťou vrátane: cyklohexanónu, kyseliny adipovej, kyseliny maleínovej, cyklohexánu, butyne, cyklohexylkarboxylovej kyseliny atď.
[TOC]
Konštrukcia cyklohexénu
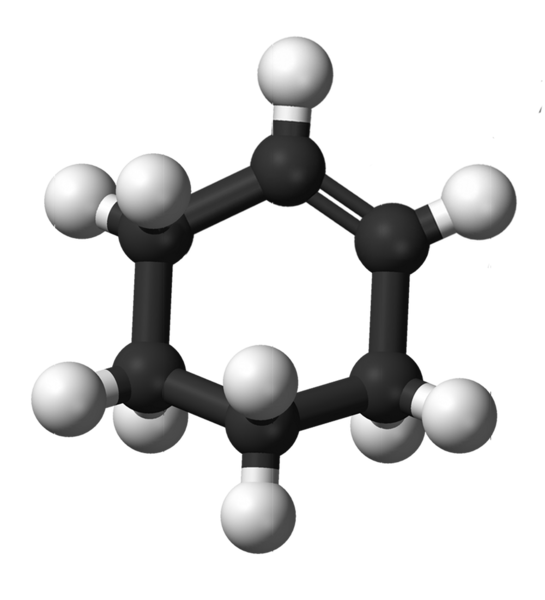 Konštrukcia cyklohexénu. Zdroj: Kemikungen [verejná doména]
Konštrukcia cyklohexénu. Zdroj: Kemikungen [verejná doména] Horný obrázok zobrazuje štruktúru cyklohexen s modelom guľôčok a tyčí. Môžete si všimnúť šesťkarbónový krúžok a dvojitú väzbu, obidve nenasýtenie zlúčeniny. Z tohto hľadiska sa zdá, že prsteň je plochý; Ale to nie je vôbec.
Na začiatok, dvojité uhlíky Bond majú hybridizáciu SP2, čo im dáva plochú trigonálnu geometriu. Preto sa tieto dva uhlíky a tie, ktoré sú k nim susediace s nimi, sa nachádzajú v rovnakej rovine; Zatiaľ čo dva uhlíky na opačnom konci (k dvojitému dlhopisu) sú nad a pod uvedenou rovinou.
Môže vám slúžiť: špecifická hmotnosťDolný obrázok dokonale ilustruje novo vysvetlený.
 Predný pohľad na konštrukciu cyklohexen. Zdroj: Ben Mills.
Predný pohľad na konštrukciu cyklohexen. Zdroj: Ben Mills. Všimnite si, že čierny prúžok sa skladá zo štyroch uhlíkov: dva z dvojitého zväzku a ostatní s nimi susedia. Exponovaná perspektíva je perspektíva, ktorá by sa získala, keby divák umiestnil jeho oko hneď pred dvojitým odkazom. Potom je zrejmé, že uhlík je hore a pod týmto lietadlom.
Pretože molekula cyklohexen nie je statická, vymenia sa dva uhlíky: jeden klesne, zatiaľ čo druhý stúpne nad rovinou. Takže by sa očakávalo, že sa bude správať touto molekulou.
Intermolekulárne interakcie
Cyclohexen je uhľovodík, a preto jeho intermolekulárne interakcie sú založené na londýnskych disperzných silách.
Je to preto, že molekula je apolar, bez permanentného dipólu a jej molekulová hmotnosť je faktor, ktorý najviac prispieva k jej udržiavaniu súdržnosti v kvapaline.
Podobne dvojitá väzba zvyšuje stupeň interakcie, pretože sa nemôže pohybovať s rovnakou flexibilitou ako u ostatných uhlíkov, čo uprednostňuje interakciu medzi susednými molekulami. Z tohto dôvodu má cyklohexen mierne väčší bod varu (83 ° C) ako bod cyklohexánu (81 ° C).
Vlastnosti
Chemické názvy
Cyklohexen, tetrahydribenzén.
Molekulová hmotnosť
82 146 g/mol.
Fyzický vzhľad
Bezfarebná tekutina.
Vôňa
Sladká vôňa.
Bod varu
83 ° C až 760 mmHg.
Bod topenia
-103,5 ° C.
zapaľovač
-7 ° C (zatvorený šálka).
Rozpustnosť
Prakticky nerozpustné (213 mg/l).
Rozpustnosť v organických rozpúšťadlách
Misilné s etanolom, benzénom, tetrachloridom uhlíkom, ropným éterom a acetónom. Očakáva sa, že bude schopný rozpustiť apolárne zlúčeniny, ako napríklad niektoré z uhlia alotropov.
Môže vám slúžiť: Torio: Štruktúra, vlastnosti, získanie, použitieHustota
0,810 g/cm3 pri 20 ° C.
Hustota pary
2,8 (s vzdušným vzťahom považovanými ako rovný 1).
Tlak vodnej pary
89 mmHg pri 25 ° C.
Sebaprečovanie
244 ° C.
Rozklad
Rozkladá sa v prítomnosti uránových solí pod pôsobením slnečného žiarenia a ultrafialového žiarenia.
Hrebeň
0,625 MPASCAL pri 25 ° C.
Spaľovacie teplo
3.751,7 kJ/mol pri 25 ° C.
Odparovanie
30,46 kJ/mol pri 25 ° C.
Povrchové napätie
26,26 Mn/m.
Polymerizácia
Môže polymerizovať za určitých podmienok.
Prah
0,6 mg/m3.
Index lomu
1 4465 až 20 ° C.
pH
7-8 až 20 ° C.
Stabilita
Cyklohexen nie je počas dlhodobého skladovania príliš stabilný. Vystavenie svetlu a vzduchu môže spôsobiť výrobu peroxidov. Je tiež nezlučiteľná so silnými oxidačnými činidlami.
Reakcie
-Cykloalky majú hlavne reakcie na pridanie, elektrofilné aj voľné radikály.
-Reaguje s brómom za vzniku 1,2-dibromocycyklohexan.
-Rýchlo oxiduje v prítomnosti permanganánu draslíka (KMNO4).
-Je schopný produkovať epoxid (oxid cyklohexen) v prítomnosti kyseliny peroxibenzoovej.
Syntéza
Cyklohexen sa produkuje katalýzou kyslého cyklohexanolu:
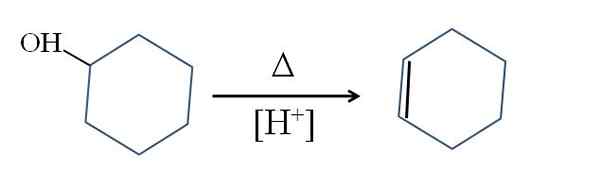 Dehydratácia cyklohexanolu. Zdroj: Gabriel Bolívar.
Dehydratácia cyklohexanolu. Zdroj: Gabriel Bolívar. Symbol A predstavuje teplo potrebné na podporu výstupu skupiny OH ako molekuly vody v kyslom médiu (-OH2+).
Cyklohexen sa vyskytuje aj čiastočnou hydrogenáciou benzénu; To znamená, že dve z jeho dvojitých väzieb pridávajú molekulu vodíka:
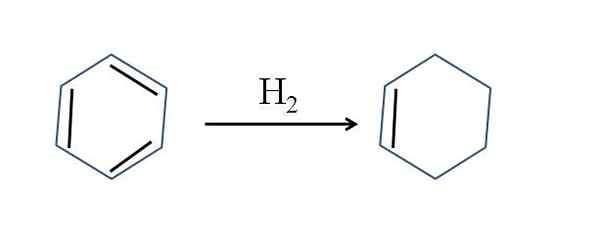 Čiastočná hydrogenácia benzénu. Zdroj: Gabriel Bolívar.
Čiastočná hydrogenácia benzénu. Zdroj: Gabriel Bolívar. Aj keď sa reakcia zdá byť jednoduchá, vyžaduje skvelú h2 a katalyzátory.
Žiadosti
-Má užitočnosť ako organické rozpúšťadlo. Okrem toho je to surovina na výrobu kyseliny adipovej, adipického aldehydu, kyseliny maleovej, cyklohexanu a cyklohexylkarboxylovej kyseliny.
Môže vám slúžiť: rádioaktivita-Používa sa na výrobu chloridu cyklohexanu, zlúčeniny používanej ako sprostredkovateľ prípravy farmaceutických výrobkov a trenia prísady.
-Cyklohexen sa tiež používa v syntéze cyklohexanónu, suroviny na výrobu liekov, pesticídov, parfumov a farbív.
-Cyklohexen zasahuje do syntézy aminocyklohexanolu, zlúčeniny, ktorá sa používa ako povrchovo aktívna látka a emulgátor.
-Okrem toho sa cyklohexen môže použiť na prípravu v laboratóriu butadieno. Táto posledná zlúčenina sa používa pri výrobe syntetického gumy, pri vypracovaní pneumatík automobilov a používa sa tiež pri vypracovaní akrylových plastov.
-Cyklohexen je surovina pre syntézu lyzínu, fenol, polycylofinovú živicu a gumové prísady.
-Používa sa ako stabilizátor vysokých oktánových benzínov.
-Zasahuje do syntézy nepremokavých povlakov, filmov odolných voči trhlinám a viazaným priečinkom pre povlaky.
Riziká
Cyklohexen nie je veľmi toxická zlúčenina, ale môže to spôsobiť kontaktom sčervenania kože a očí. Jeho vdýchnutie môže produkovať kašeľ a ospalosť. Okrem toho jeho požitie môže spôsobiť ospalosť, ťažkosti s dýchaním a nevoľnosťou.
Cyklohexen je málo absorbovaný v gastrointestinálnom trakte, takže sa neočakávajú vážne systémové účinky kvôli jeho požitiu. Maximálna komplikácia je jej aspirácia pre respiračný systém, ktorý môže produkovať chemickú pneumóniu.
Odkazy
- Joseph F. Chiang a Simon Harvey Bauer. (1968). Molekulárna štruktúra cyklohexénu. J. Hod. Chem. SOC. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyklohexén: nebezpečenstvo, syntéza a štruktúra. Štúdium. Získané z: štúdie.com
- Morrison, r. Tón. A Boyd, r. N. (1987). Organická chémia. (5ubytovať sa Vydanie.). Redakcia Addison-Wesley Iberoamericana.
- Publikácia. (2019). Cyklohexén. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Chemická kniha. (2019). Cyklohexén. Obnovené z: Chemicalbook.com
- Toxikologická dátová sieť. (2017). Cyklohexén. Tónovanie. Získané z: Toxnet.NLM.NIH.Vláda
- Chemoxy. (s.F.). Štrukturálny vzorec pre cyklohexén je. Obnovené z: chemoxy.com

