Vlastnosti kyanidu draselného (KCN), použitia, štruktúry, riziká,

- 1303
- 5
- Valentín Dula
On Kyanid draselného Je to anorganická zlúčenina tvorená iónovou draslíkom k+ a CN kyanidový ión-. Jeho chemický vzorec je KCN. Je to kryštalická biela pevná, mimoriadne jedovatá.
KCN je veľmi rozpustný vo vode a pri rozpustení sa hydrolyzuje a tvorí kyselinu cyanhydrovú alebo kyanid vodíka HCN, čo je tiež veľmi jedovaté. Kyanid draselný môže tvoriť zložené soli so zlatom a striebrom, takže sa použil na extrahovanie týchto drahých kovov z určitých minerálov.
 Pevný kyanid draselný KCN. Morienus (odovzdané DE: Benutzer: Bxxxd z: wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons.
Pevný kyanid draselný KCN. Morienus (odovzdané DE: Benutzer: Bxxxd z: wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]]. Zdroj: Wikimedia Commons. KCN sa používa na pokrytie lacných kovov so zlatom a striebrom prostredníctvom elektrochemického procesu, to znamená metóda, pri ktorej elektrický prúd prechádza roztokom, ktorý obsahuje soľ zloženú z drahého kovu, kyanidu a draslíka.
Kyanid draselný, pretože obsahuje kyanid, musí byť manipulovaný s veľkou opatrnosťou s primeranými náradím. Nikdy by sa nemala vyradiť do životného prostredia, pretože je tiež veľmi toxická pre väčšinu zvierat a rastlín.
Avšak metódy, ktoré používajú bežné riasy.
[TOC]
Štruktúra
KCN je iónová zlúčenina tvorená katiónom draslíka k+ a anión kyanidu cn-. V tomto je atóm uhlíka spojený s atómom dusíka prostredníctvom trojitej kovalentnej väzby.
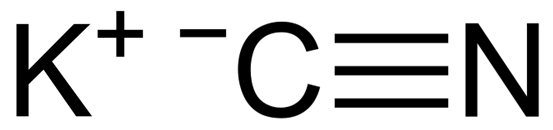 Chemická štruktúra kyanidu draselného KCN. CAPACIO [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Chemická štruktúra kyanidu draselného KCN. CAPACIO [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. V pevnom kyanide draselného CN anión- Môže sa voľne otáčať tým, čo sa správa ako sférický anión, v dôsledku.
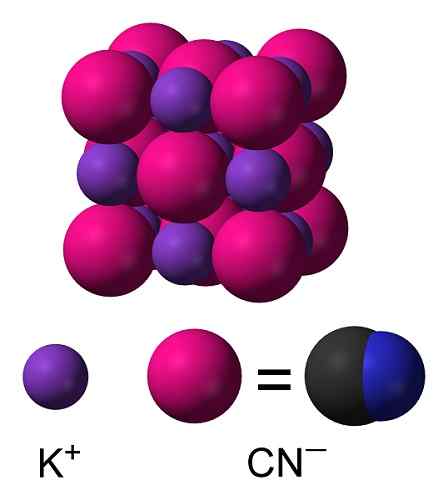 Kryštálová štruktúra KCN. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Kryštálová štruktúra KCN. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
- Kyanid draselného
- Kyanid draselného
- Cianopotasio
Vlastnosti
Fyzický stav
Biela kryštalická pevná látka. Kubické kryštály.
Molekulová hmotnosť
65,116 g/mol.
Bod topenia
634,5 ° C
Môže vám slúžiť: sulfát z hliníka (AL2 (SO4) 3)Bod varu
1625 ° C.
Hustota
1,55 g/cm3 pri 20 ° C.
Rozpustnosť
Veľmi rozpustné vo vode: 716 g/l pri 25 ° C a 100 g/100 ml vody pri 80 ° C. Malé rozpustné v metanole: 4,91 g/100 g metanolu pri 19,5 ° C. Veľmi málo rozpustné v etanole: 0,57 g/100 g etanolu pri 19,5 ° C.
pH
Vodný roztok 6,5 g KCN v 1 l vode má pH 11,0.
Konštantná hydrolýza
KCN je veľmi rozpustný vo vode. Keď je kyanidový ión CN zadarmo- čo trvá protón h+ vody za vzniku kyseliny HCN cyanhydrovej a uvoľnenie OH iónu-:
CN- + H2O → HCN + OH-
Konštanta hydrolýzy naznačuje trend, ktorým sa vykonáva uvedená reakcia.
Klimatizovaťh = 2,54 x 10-5
Vodné roztoky KCN uvoľňujú prostredie kyanidu HCN vodíka, keď sa zahrievajú 80 ° C.
Chemické vlastnosti
Nie je to horľavé, ale keď sa tuhá látka KCN zahrieva, až kým jeho rozklad nevydie veľmi toxický kyanid vodíka HCN, oxidy dusíka nie súX, Oxid k -trasi2O a oxid uhoľnatý.
KCN reaguje so zlatými soľami tvoriacimi draselný aurocianuro kau (CN)2 a draselný auricianuro kau (CN)4. Toto sú komplexy bezfarebné soli. S strieborným kovovým AG tvorí KCN draslík argentocyanid KAG (CN)2.
Kyanidový ión KCN reaguje s určitými organickými zlúčeninami, ktoré majú halogén (ako je chlór alebo bróm) a zaberá ich miesto z nich. Napríklad reaguje s kyselinou bromooctovou, čím poskytuje kyselina kyanooctová.
Ďalšie vlastnosti
Je hygroskopický, absorbuje vlhkosť životného prostredia.
Má jemnú vôňu horkých mandlí, ale to nie sú zistené všetkými ľuďmi.
Získanie
KCN sa pripravuje reakciou hydroxidu draselného KOH vo vodnom roztoku s kyanidom HCN vodíka. Ferokyanid draselný K sa získa tiež zahrievaním4Viera (CN)6:
Klimatizovať4Viera (CN)6 → 4 kcn + 2 c + n2↑ + viera
Používajte v kovovej elektróde
Používa sa v procese pokrytia malých cenných kovov so zlatom a striebrom. Je to elektrolytický proces, to znamená, že elektrina prechádza vodným roztokom s vhodnými soľami.
Môže vám slúžiť: Sírovitý oxid (SO3): Štruktúra, vlastnosti, riziká, použitiaStriebro
Používa sa argentocyanid draslíka (CN)2 Na povlak lacnejšími kovmi (AG).
Sú umiestnené vo vodnom roztoku draselného KAG (CN)2, Kde pozitívna anóda alebo pól je čisto strieborná tyčinka (AG) a katóda alebo negatívny stĺp je lacný kov, ktorý sa chystá striekať strieborné.
Ako elektrický prúd prechádza roztokom, striebro sa ukladá na druhý kov. Keď sa používajú kyanidové soli, strieborná vrstva sa ukladá jemnejším, kompaktnejším a adherentnejším spôsobom ako v roztokoch iných zlúčenín.
 Niektoré šperky sú pokryté striebrom pomocou solí KCN. Autor: Stocksnap. Zdroj: Pixabay.
Niektoré šperky sú pokryté striebrom pomocou solí KCN. Autor: Stocksnap. Zdroj: Pixabay. Zlato
Podobne v prípade zlata (Au), draselný aurocyanid Kau (CN)2 a draselný auricianuro kau (CN)4 Ostatné kovy sa používajú na elektrolyticky hnedé.
 Elektrické konektory potiahnuté zlatom pravdepodobne pomocou solí KCN. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Elektrické konektory potiahnuté zlatom pravdepodobne pomocou solí KCN. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Iné použitia
Niektoré ďalšie použitia kyanidu draselného sú uvedené nižšie.
- Pre priemyselný proces tvrdenia nitrácie ocele (pridanie dusíka).
- Na čistenie kovu.
- V procesoch tlače a fotografie.
- Predtým sa použil na extrakciu zlata a striebra z minerálov, ktoré ich obsahujú, ale potom bol nahradený kyanidom NaCN sodným, ktorý je lacnejší, aj keď rovnako toxický.
- Ako insekticíd na fumigáciu stromov, lodí, železničných automobilov a skladov.
- Ako činidlo v analytickej chémii, to znamená vykonať chemickú analýzu.
- Na prípravu ďalších chemických zlúčenín, ako sú farbivá a farbivá.
 Zlato v Južnej Afrike v roku 1903 pomocou KCN, čo bolo v smrteľnom znečistení okolitého prostredia. Argyll, John Douglas Sutherland Campbell, vojvoda z 1845-1914; Creswicke, Louis [žiadne obmedzenia]. Zdroj: Wikimedia Commons.
Zlato v Južnej Afrike v roku 1903 pomocou KCN, čo bolo v smrteľnom znečistení okolitého prostredia. Argyll, John Douglas Sutherland Campbell, vojvoda z 1845-1914; Creswicke, Louis [žiadne obmedzenia]. Zdroj: Wikimedia Commons. Riziká
KCN je veľmi jedovatá zlúčenina pre zvieratá a väčšinu rastlín a mikroorganizmov. Je klasifikovaný ako super toxický. Stále je smrteľná vo veľmi malých množstvách.
Môže vám slúžiť: nikel chlorid (NICL2): Štruktúra, vlastnosti, získanie, použitiaJeho škodlivý účinok sa môže vyskytnúť vdýchnutím, kontaktom s pokožkou alebo očami alebo požitím. Inhibuje mnoho metabolických procesov, najmä krvných bielkovín, ktoré sa podieľajú na transporte kyslíka, ako je hemoglobín.
Ovplyvňuje orgány alebo systémy citlivejšie na nedostatok kyslíka, ako je centrálny nervový systém (mozog), kardiovaskulárny systém (srdcové a krvné cievy) a pľúca.
 Kyanid draselný je jed. Autor: Clker-Free-Vector-Images. Zdroj: Pixabay.
Kyanid draselný je jed. Autor: Clker-Free-Vector-Images. Zdroj: Pixabay. Mechanizmus akcie
KCN narúša schopnosť tela používať kyslík.
Kyanidový ión CN- KCN má veľkú príbuznosť k viere železitej viery3+, Čo znamená, že keď ho kyanid absorbuje, rýchlo reaguje s vierou3+ Krv a tkanivá.
Týmto spôsobom bráni dýchaniu buniek, ktoré vstupujú do stavu nedostatku kyslíka, pretože hoci sa snažia dýchať, nemôžu ho použiť.
Vyskytuje sa potom prechodný stav hipperapnoe (dýchacie zavesenie) a bolesti hlavy a nakoniec smrť zatknutím dýchacích ciest.
Ďalšie riziká
Pri zahrievaní produkuje veľmi toxické plyny, ako je HCN, oxidy dusíkaX, Oxid k -trasi2O a oxid uhoľnatý.
Po kontakte s vlhkosťou HCN, ktorá je vysoko horľavá a veľmi toxická.
KCN je tiež veľmi jedovatá pre vodné organizmy. Nikdy by sa nemalo vyradiť do životného prostredia, pretože sa môže vyskytnúť znečistenie vody, kde pijú zvieratá a obývajú ryby.
Existujú však baktérie, ktoré produkujú kyanid, ako napríklad Chromobakterium violaceum a niektoré druhy Pseudomonas.
Nedávne štúdie
Niektorí vedci zistili, že zelené riasy Chlorella vulgaris Môže sa použiť na ošetrenie kontaminovaných vôd kyanidom draselným kyanidom KCN v nízkych koncentráciách.
Riasy boli schopné účinne odstrániť KCN, pretože to v nízkych množstvách stimulovalo rast rias, pretože aktivoval vnútorný mechanizmus, aby odolal toxicite KCN.
To znamená, že riasy Chlorella vulgaris Má potenciál odstrániť kyanid a že s tým by sa mohla navrhnúť účinná metóda biologickej liečby kontaminácie kyanidu.
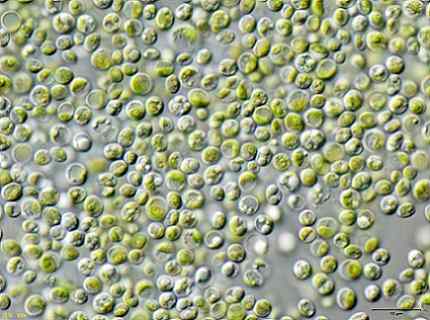 Obraz Chlorella vulgaris pozorované v mikroskope. JA: Používateľ: Neon / User: neon_ja [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Obraz Chlorella vulgaris pozorované v mikroskope. JA: Používateľ: Neon / User: neon_ja [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Kyanid draselného. Národné centrum pre biotechnologické informácie. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Coppock, r.W. (2009). Hrozby pre divočinu agentmi chemických bojov. V príručke toxikológie chemických vojnových agentov. Zotavené z vedeckých pracovníkov.com.
- Liu, Q. (2017). Vyhodnotenie odstránenia kyanidu draselného a jeho toxicity v zelených rianoch (Chlorella vulgaris). Bull prostredie kontam toxicol. 2018; 100 (2): 228-233. NCBI sa zotavila.NLM.NIH.Vláda.
- Národný inštitút pre bezpečnosť a zdravie pri práci (NIOSH). (2011). Kyanid draselný: systémové činidlo. CDC sa obnovil.Vláda.
- Alvarado, L.J. a kol. (2014). Objavenie, štruktúra a funkcia riboswitch. Syntéza uracilu. V metódach v enzymológii. Zotavené z vedeckých pracovníkov.com.
- « Štruktúra sodného tripolifosforečnanu (Na5P3O10), vlastnosti, použitia, náraz
- Pretože som veľmi ospalý? 9 príčin a riešení »

