Elektrochemické bunky

- 1760
- 460
- Gabriel Bahna
Čo sú elektrochemické bunky?
Ten elektrochemické bunky Sú to zariadenia, v ktorých chemické reakcie prechádzajú, kde sa chemická energia transformuje na elektrinu alebo naopak. Tieto bunky tvoria srdce elektrochémie, pričom duša je potenciálna výmena elektrónov, ktoré sa môžu vyskytnúť, spontánne alebo nie spontánne, medzi dvoma chemickými druhmi.
Jeden z týchto dvoch druhov oxiduje, stráca elektróny, zatiaľ čo druhý je znížený víťazstvom s ceded elektrónmi. Znížený druh, ktorý je redukovaný, je kovový katión v roztoku, ktorý získaním elektricky končí elektricky na elektróde vyrobenej z toho istého kovu. Na druhej strane, druh, ktorý oxiduje, je kov, ktorý sa stáva kovovými katiónmi.
 Daniel's Electrochemical Cell Diagram. Zdroj: Rechua [CC By (https: // creativeCommons.Org/licencie/o/3.0)]
Daniel's Electrochemical Cell Diagram. Zdroj: Rechua [CC By (https: // creativeCommons.Org/licencie/o/3.0)] Napríklad vynikajúci obraz predstavuje Danielovu bunku: najjednoduchšie zo všetkých elektrochemických buniek. Kovová zinková elektróda je oxidovaná a uvoľňuje katióny Zn2+ do vodného prostredia. K tomu dochádza v nádobe ZnSO4 zľava.
Vpravo roztok obsahujúci Cuo4 Je znížená, transformujúca katióny cu2+ V kovovej meďi, ktorá je uložená na medenej elektróde. Počas vývoja tejto reakcie elektróny prechádzajú vonkajším obvodom aktivujúcim ich mechanizmy; A preto poskytovanie elektriny na prevádzku zariadenia.
Komponenty elektrochemických buniek
Elektróda
V elektrochemických bunkách sa generujú alebo konzumujú. Aby sa zabezpečil správny tok elektrónov, musia existovať materiály, ktoré sú dobré vodiče elektriny. To je miesto, kde prichádzajú elektródy a externý obvod, vybavené medeným zapojením, strieborným alebo zlatom.
Elektródy sú materiály, ktoré poskytujú povrch, kde sa vyvinú reakcie v elektrochemických bunkách. Existujú dva typy podľa reakcie, ktorá sa v nich vyskytuje:
- Anóda, elektróda, kde sa vyskytuje oxidácia.
- Katóda, elektróda, kde dochádza k redukcii.
Elektródy môžu byť vyrobené z reagujúceho materiálu, ako v prípade Danielovej bunky (zinok a meď); Alebo z inertného materiálu, ako je to v prípade, keď sú vyrobené z platiny alebo grafitu.
Elektróny priradené anódou musia dosiahnuť katódu; Ale nie cez roztok, ale cestovanie kovovým káblom, ktorý spája obe elektródy k vonkajšiemu obvodu.
Rozpustenie elektrolytov
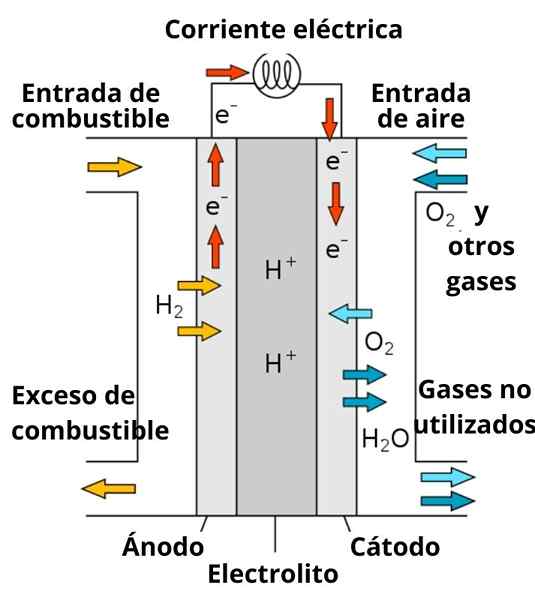 Schéma protónov vodivej palivovej batérie
Schéma protónov vodivej palivovej batérie Rozpúšťanie, ktoré obklopuje elektródy, tiež hrá dôležitú úlohu, pretože je obohatená o silné elektrolyty; ako: KCL, KNO3, NaCl, atď. Tieto ióny do istej miery uprednostňujú migráciu elektrónov z anódy do katódy, ako aj ich vedenie v blízkosti elektród, aby interagovala s druhom, aby sa znížila.
Morská voda napríklad vedie oveľa lepšiu elektrinu ako destilovaná voda s nižšou koncentráciou iónov. Preto majú elektrochemické bunky roztok silných elektrolytov medzi svojimi komponentmi.
Soľný most
Ióny roztoku začínajú obklopovať elektródy spôsobujúce polarizáciu záťaží. Rozpustenie okolo katódy sa začína nabíjať negatívne, pretože sa znižujú katióny; V prípade Danielovej bunky, Cu Cations2+ Uložením ako kovová meď na katóde. Existuje teda deficit pozitívnych obvinení.
Tu zasahuje soľný most, aby vyvážil zaťaženie a zabránil polarizácii elektród. Na bok alebo priehradku katódových katiónov soľného mosta bude migrovať, buď k+ alebo Zn2+, Nahradiť CU2+ spotrebovaný. Medzitým sa zo soľného mosta migruje anióny3- Smerom k anódovej priehradke, aby sa neutralizovala rastúca koncentrácia katiónov Zn2+.
Môže vám slúžiť: dichromát draselný: vzorec, vlastnosti, riziká a použitiaSalínsky mostík sa skladá zo nasýteného roztoku soli, s koncami pokrytými priepustným iónovým gélom, ale vodeodolné pre vodu.
Typy elektrochemických buniek a ako fungujú
Spôsob, akým funguje elektrochemická bunka, závisí od typu, ktorý je. V zásade existujú dva typy: galvanické (alebo voltaické) a elektrolytické
Galvanika
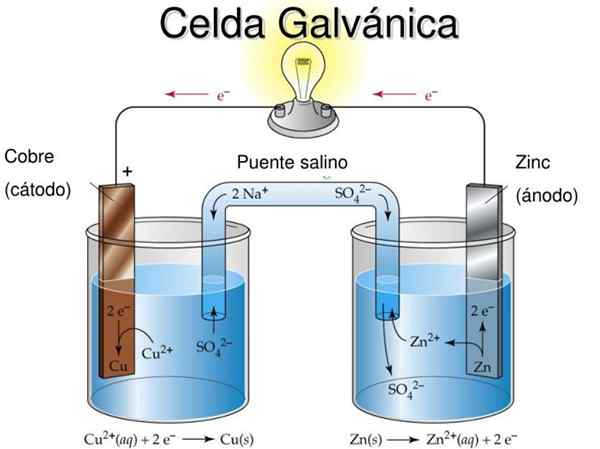
Danielova bunka je príkladom galvanickej elektrochémie bunky. V nich sa reakcie vyskytujú spontánne a potenciál batérie je pozitívny; Čím väčší je potenciál, tým väčšia je elektrina, ktorá dodá bunku.
Batérie alebo batérie sú presne galvanické bunky: chemický potenciál medzi týmito dvoma elektródami sa transformuje na elektrickú energiu, keď ich vonkajší obvod zasiahne, ktorý ich spája. Elektróny tak migrujú z anódy, zapálite zariadenie, ku ktorému je batéria pripojená, a vrátia sa priamo do katódy.
Elektrolytický
Elektrolytické bunky sú tie, ktorých reakcie sa nevyskytujú spontánne, pokiaľ nie sú dodávané elektrickou energiou z vonkajšieho zdroja. Tu dochádza k opačnému javu: Elektrina umožňuje vyvíjať sa neospontánne chemické reakcie.
Jednou z najznámejších a cenných reakcií, ktoré sa uskutočňujú v rámci tohto typu bunky, je elektrolýza.
Nabíjateľné batérie sú príkladmi elektrolytických a zároveň galvanických: nabíjajú sa, aby zvrátili svoje chemické reakcie a obnovili počiatočné podmienky na opätovné použitie.
Príklady
Danielova bunka
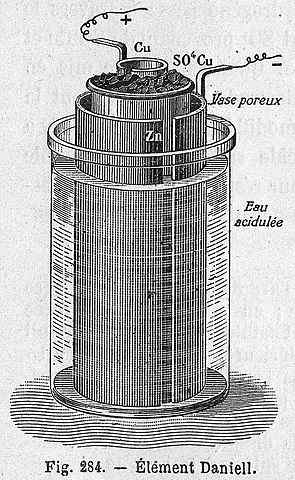 Danielova bunková schéma
Danielova bunková schéma Nasledujúca chemická rovnica zodpovedá reakcii Danielovej bunky, na ktorej sa zúčastňujú zinok a meď:
Môže vám slúžiť: Prenajmite si halogenuros: vlastnosti, získanie, príkladyZn (s) + cu2+(aq) → Zn2+(aq) + cu (s)
Ale Cu katióny2+ a Zn2+ Nie sú sami, ale sprevádzajú ani anióny42-. Táto bunka môže byť reprezentovaná takto:
Zn | Znso4 | | Cuso4 | Cu
Danielova bunka môže byť postavená v akomkoľvek laboratóriu a je veľmi opakujúca sa ako prax pri zavádzaní elektrochémie. Ako Cu2+ Je uložený ako Cu, modrá farba roztoku Cuso4 Bude to stratené.
Platina a vodíkové bunky
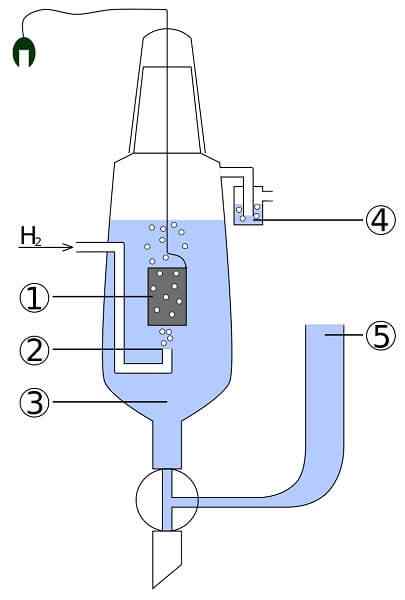 Schéma platinovej a vodíkovej bunky: 1. 2 platinová elektróda. Plynný vodík 3. Kyslý roztok 4. Hidroseal 5. Vloženie únie
Schéma platinovej a vodíkovej bunky: 1. 2 platinová elektróda. Plynný vodík 3. Kyslý roztok 4. Hidroseal 5. Vloženie únie Predstavte si bunku, ktorá konzumuje plynný vodík, produkuje kovové striebro a zároveň trvá elektrinu. Toto je platina a vodíková bunka a jej všeobecná reakcia je nasledujúca:
2Agcl (s) + h2(g) → 2AG (s) + 2H+ + 2cl-
Tu v priestore anódy máme inertnú platinovú elektródu, ponorenú do vody a do ktorej je čerpaný plynový vodík. H2 oxidovať na H+ a poskytuje svoje elektróny do mliečnej zrazeniny AGCL v katódovom priehradke s kovovou striebornou elektródou. Na tomto striebre sa zníži.
Táto bunka môže byť reprezentovaná ako:
Pt, h2 | H+ | | Cl-, AGCL | Zápis
Bunka
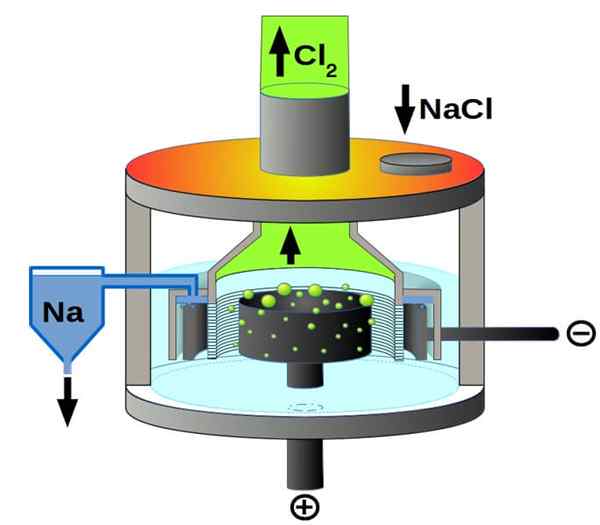 Downs bunková schéma pre elektrolýzu chloridu sodného. Zdroj: Pchemiker, CC BY-SA 4.0, cez Wikimedia Commons
Downs bunková schéma pre elektrolýzu chloridu sodného. Zdroj: Pchemiker, CC BY-SA 4.0, cez Wikimedia Commons A nakoniec, medzi elektrolytickými bunkami máme roztavený chlorid sodný, známy ako Downs Cell. Tu je vyrobená elektrina na prechádzanie elektródami objemom roztaveného NaCl, a preto v nich vznikne nasledujúce reakcie:
Druhý+(l) + 2e- → 2NA (s) (katóda)
2cl-L) → Cl2g) + 2e- (anóda)
2NACL (L) → 2NA (s) + CL2g) (globálna reakcia)
Preto je možné pripraviť kovový sodík a chlórový plyn a chlorid sodný a chlorid sodný, kovový sodík a chlór.

